神経細胞の新生の現場をおさえる(1)
海馬の顆粒細胞の観察から
石龍徳
ミクロスコピア 25(2): 19-25 (2008)より許可を得て転載
「大人の脳でもニューロンが生まれている」こんな話を聞いたことがありますか?最近脳科学では、いろいろな分野でこの話題がさかんに議論されています。しかし、この現象自体は、今から40年も前にAltmanによって発見されていました。それではなぜ、いままで「大人の脳ではニューロンは生まれない」と信じられていたのでしょうか?今回は、この現象に私が関わることになったきっかけをお話ししながら、その理由を考えてみましょう。
西暦2000年の記念すべき年、最も権威のある神経科学の総説誌Nature Reviews Neuroscienceの第1巻第1号に、「百年以上も信じられていた学説がついに崩壊!」こんな内容の総説が現れた1)。ここで、百年以上も信じられていた学説とは、「大人の脳ではニューロンは生まれない」とのドグマだ。実際、つい最近までどの教科書にもそのように書かれていた。しかし、現在ではこの学説に代わって、「脳の一部(海馬と嗅球)では大人になってもニューロンが生まれている」との考え方が広く認められるようになり、教科書の記述も書き改められるようになってきている。この「成体脳のニューロン新生」が話題になり始めたのは、今から10年前の1998年頃だが、それ以来この分野の研究は爆発的に増え、今では毎年おびただしい数の論文が科学雑誌に掲載されている。日本でも海外でもまるでお祭り騒ぎだ。
それはなぜ重要なのか?
「成体脳のニューロン新生」がなぜそれほど大きな話題なのか?それはこの話題が、再生医療と学習・記憶という二つの大きな分野の今までの常識を覆してしまうからだ。
再生医療で重要なのは、それぞれの臓器の細胞を作り出す能力のある幹細胞である。例えば、表皮には表皮を作る幹細胞があるので、傷がついても修復される。このような幹細胞を利用すれば、さまざまな臓器を再生することが出来る。しかし、いくつかの臓器では、胎生期にあった幹細胞は、成体になるとなくなってしまう。脳はそのような臓器の代表であり、成体脳には、幹細胞は存在しないと考えられていた。したがって、幹細胞によって脳が修復される可能性はないと信じられていた。これは臓器の修復を考える上で絶望的な状況である。しかし、成体の脳に幹細胞(神経幹細胞)があれば、その幹細胞を利用して脳組織を修復出来るかも知れない。また、神経幹細胞の増殖・分化の仕組みや、神経幹細胞が神経回路に組み入れられる仕組みが解明されれば、神経幹細胞を人工的に作り出すことや、その神経幹細胞を移植したときに機能的な神経回路を作り出せるかも知れない。これは今まで夢でしかなかった脳組織の再生医療が現実になる可能性を示している。
もう一つの話題である学習・記憶で重要なのは、シナプスの可塑性である。学習・記憶の成立過程では、さまざまな感覚が脳に入力すると、神経細胞どうしの結合部であるシナプスに変化が起こり、その変化が脳に残ると考えられている。このような変化をシナプスの可塑性と呼ぶ。シナプスの可塑性は、具体的には、シナプスの電気生理学的な性質や、樹状突起・軸索の小さな形態の変化「発芽」である。このようなシナプスの可塑性と記憶・学習の関係は、脳の中でも特に海馬という部分で盛んに研究されていた。なぜなら、てんかんの治療のために海馬を摘出された患者が、顕著な記憶障害を起こすからである。記憶・学習の成立過程では、大脳皮質の知覚情報は、まず海馬の顆粒細胞に入力し、その後、錐体細胞などが作る神経回路を一周して、再び大脳皮質に出力されると考えられている(図1)。興味深いことに、知覚情報を最初に受け取る顆粒細胞は、成体になっても新生され続けている。顆粒細胞が新生すると、樹状突起と軸索を伸ばし、そこには莫大な数の新しいシナプスが形成されるだろう。このような大規模なシナプス形成が、海馬の入り口である顆粒細胞で知覚情報依存的に起これば、それは記憶・学習の成立過程で大きな役割を果たすに違いない。この様な考えは、小さなシナプスの変化を中心に研究されていた、今までの学習・記憶のメカニズムの前提を覆してしまうほど、大きなパラダイムの転換である。
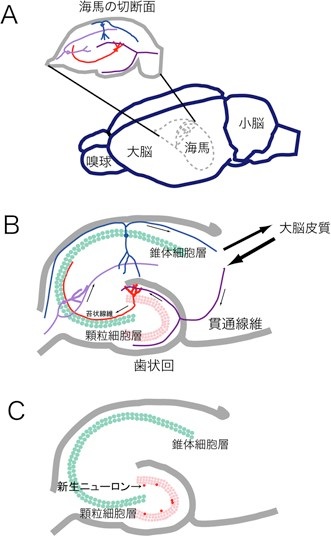
図1 A.ラット脳における海馬の位置。海馬は大脳の中に埋もれている。B. 海馬の神経回路。顆粒細胞(赤)は大脳皮質からの知覚情報を受け取る。C. 顆粒細胞層の内側では成体になってもニューロンが新生している(赤丸)。
まずは道具作りから
私も「成体脳におけるニューロン新生」を研究テーマとしているので、「ああ、あの流行の研究をしているのですね」などと思われてしまうのだが、私が研究を始めたのは「成体脳のニューロン新生」が話題になる前の1990年前後で、その頃、このテーマで研究していたのは、世界でたった2箇所(ロックフェラー大学の2つのグループと、順天堂大学の私)だけだった。
なぜ、私が「成体脳におけるニューロン新生」の研究を始めたのか?まずそのお話をしよう。私が、順天堂大学医学部解剖学第二講座に就職したのは1987年だった。第二講座は脳の性差の研究で有名な新井康允教授の率いるグループである。新井先生との最初のお話で、研究についてお尋ねした時、当然脳の性差に関連する研究についてのお話が出ると思ったのだが、「好きなことをやって良いよ」という意外なお返事だった。その言葉を受けて一年間、いろいろな研究をかじってみたが、はっきりしたテーマは定まらず、結局まずは道具作りから始めることにした。
具体的には、脳の性分化を調べるために便利な、雄と雌の脳を識別する抗体と、神経の発生を調べるのに便利な、胎仔と成体の脳を識別するモノクローナル抗体を作ることに挑戦した。その結果、前者の抗体は最後まで採れなかったが、胎仔の脳と特異的に反応する抗体の方は、どうにか1つだけ採れた。その後、さまざまな解析をしたところ、この抗体の認識する抗原分子は、神経細胞接着分子(neural cell adhesion molecule, NCAM)を修飾する糖鎖ポリシアル酸(polysialic acid, PSA)であることが明らかになった2)。
自分の採った抗体が、新規の分子を認識する抗体でないことにがっかりしたが、それまでに2-3年の月日を費やしてしまったので、このPSAに対する抗体を使って、神経発生を研究する仕事を始めた(図2)。まず大脳新皮質の発生を調べたところ、発生初期の神経上皮細胞や、脳室層の未分化な増殖細胞にはPSAの発現が見られなかったが、それらの細胞が未熟ニューロンに分化するとPSAの発現が見られるようになった。PSAは発生後期から生後初期にかけて、ニューロンが移動したり突起を伸ばしたりする時期に強く発現し、シナプス形成が終わる生後2週間目には発現が著しく低下した。そして成体になると、PSAを強く発現する神経細胞はほとんど見られなかった。このことからPSA抗体が発達中のニューロンを解析するのに非常に良いツールであることが明らかになった。以上の結果を論文としてまとめたが2)、PSAが神経発生に重要であることは、脊髄や末梢神経-筋で、すでに発表されていたので、やや当たり前すぎる感じがして、面白味に欠けていた。
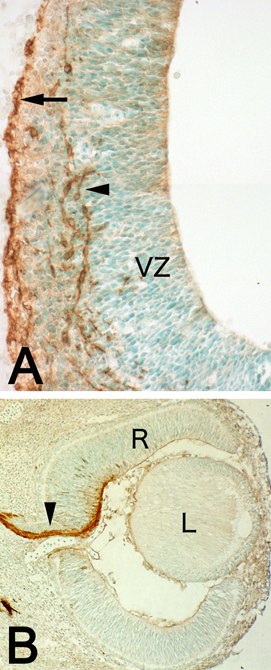
図2 胎生14日目のラットの神経発生。A. 大脳皮質。未分化な増殖細胞の存在する脳室層(VZ)には、PSAは発現していない。PSAは、ニューロンが最初に現れる辺縁層(矢印)や、中間層を移動するニューロン(矢頭)に発現している。B. 眼。PSAは、網膜(R)の神経細胞が軸索(矢頭)を脳側に伸ばす時に発現する。Lはレンズ。
成体脳に未熟なニューロン?
ただ、この仕事をやりながら気がかりなことがいくつかあった。その一つは、成体になっても、海馬の顆粒細胞層の内側にだけPSA陽性細胞が存在することだ3)。顆粒細胞層には小さなニューロンが5-6個密に並び層を形成しているが、その一番内側にだけPSAを胎生期のように強く発現する細胞があり、樹状突起と軸索を伸ばしていた(図3)。その特徴的な形態からPSA陽性細胞が顆粒細胞であることは確かだが、なぜ、発達中のニューロンに発現するPSAが、成体の脳に強く発現しているのだろう?またなぜ、同じ顆粒細胞でも、一番内側の細胞にだけ、PSAは発現しているのだろう?これらのことが心に引っかかっていた。
そんなある日、教室にある1975年出版の本「 The Hippocampus(海馬)」を開いてみると、そこには、海馬では成体になってもニューロンの新生が続いているという、まったく聞いたことがない不思議な話が、Joseph Altmanという学者によって書かれていた4)。早速、図書館に行ってそのオリジナル論文を見てみると、放射性同位元素のチミジンのオートラジオグラフィーを使って、生後の海馬のニューロン新生を詳細に調べていた5)。図を見ると、放射性同位元素を取り込んで、銀粒子で黒く標識された核が、顆粒細胞層内側の顆粒細胞にだけ存在していた。まさに、PSA発現細胞が見られたその場所だ!PSAが発達中のニューロンに発現していることと、Altmanの論文の結果を合わせれば、予想される結論は、成体の海馬でPSAを発現している細胞は、新生したニューロンである、ということだ。
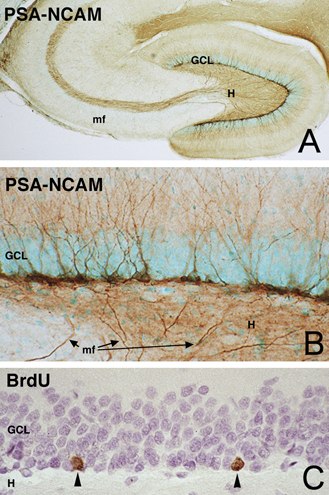
図3 成体ラットの海馬。A, B. 顆粒細胞層(GCL)の内側にPSA陽性細胞が見られる。顆粒細胞の軸索である苔状線維(mf)にもPSAは発現している。C. BrdUを投与して検出された新生細胞(矢頭)。Hは歯状回門。
世界で初めて見たその姿!
この仮説をどうにかして確かめたい。最初はAltmanと同様に放射性同位元素を使って実験をしようと計画したが、乳剤が放射性同位元素に感光するのに数ヶ月を要することや、PSAの免疫組織化学との組み合わせを考えて、躊躇していた。そんなとき、発生学関係の科学雑誌で、チミジン類似物質のブロモデオキシウリジン(BrdU)を利用して分裂細胞を検出出来ることを知った。分裂細胞はDNA合成時に、チミジンと勘違いしてBrdUを取り込む、その組織中のBrdUを、BrdU抗体を使って免疫組織化学的に検出できるのだ。さらに図書館で、神経系でBrdUを使っている論文を調べてみると、Richard S Nowakowskiらが胎生期のラットに投与して、神経発生を調べていることがわかった6)。胎生期のラットの神経発生に使えるなら、成体脳の神経発生にも使えるはずだ。早速、BrdUを成体ラットに投与して、2週間後にPSA抗体とBrdU抗体を使って免疫二重染色をしてみた7)。BrdUを青い色素で検出し、PSAを茶色の色素で検出してみると、樹状突起を伸ばした茶色いPSA陽性顆粒細胞の核が青く染まっていた(図4)。これは、成体海馬で2週間前に生まれた細胞が樹状突起を発達させている姿だ!こんなに面白い現象があるなんで信じられない。しかも、BrdU投与後80日後では、BrdU標識細胞にPSAの発現は全く見られなかった。つまり、PSAは発達中のある限られた時期にだけニューロンに発現していることになる。それにしても、成体の海馬でニューロンが新生している事実はなぜ世の中に知られていないのだろう?いや、こんなに面白い現象なら世界のだれかが研究しているに違いない?今だったら、コンピュータを使ってPubMedで調べればすぐに解るが、当時は図書館に入り浸りで調べるしかなかった。
いろいろと文献を調べてみると、Altmanは1960年代から70年代にかけて多数の論文を出版していることが分かった4)。その中には、生後初期ラットの脳に放射線を当てて、分裂細胞を殺すと顆粒細胞層の形成に障害が起こるなど今から考えても非常に重要な論文が多い。その後、「成体脳のニューロン新生」の研究をさらに推し進めたのは、ボストン大学(後にニューメキシコ大学)のMichael S. Kaplanだった。彼は、1970年代後半から1980年代前半にかけて、オートラジオグラフィーと電子顕微鏡を組み合わせた実験を行い、新生細胞上にシナプスが形成されることを示した8, 9)。彼の電顕写真は見事なもので、新生細胞がニューロンであることを明確に示すと同時に、その細胞がニューロンとして神経回路に確かに組み込まれていることを如実に示している。しかも、この実験を老齢ラットでも行い、高齢になってもニューロンが新生し、海馬に新しい神経回路を追加されていることを証明している。このように、成体脳のニューロン新生についてかなり明確な情報が有りながら、どういう訳か、この分野の研究は現在のように広まらなかった。
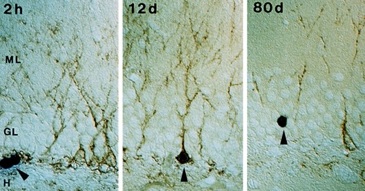
図4 PSAはニューロンの発達期に発現する。BrdU投与後、2時間(2h)、12日後(12d)、80日後(80d)に新生細胞のPSA発現を調べた。2時間後では、BrdUで標識された新生細胞(青色、矢頭)にPSA(茶色)は発現していないが、12日後には新生細胞の細胞体や樹状突起にPSAが発現している。しかし、80日後では、PSAの発現は消失している。
鳥の歌
ほ乳類の「成体脳のニューロン新生」の研究がこのような状態であった1980年代に、ロックフェラー大学のFernando Nottebohmのグループは、鳥類を使って「成体脳のニューロン新生」の研究を始めた10)。この研究の面白い点は、ニューロン新生が、鳥の歌の学習と関係することを明らかにした点である。彼らの用いたカナリアの雄は、毎年新しい歌を繁殖期の前に覚える。そして繁殖期の後にはその歌を忘れ、次の繁殖期までにまた新しい歌を覚える。Nottebohmらは、このような鳥の歌の学習に関連する脳の部位(HVCやRAと呼ばれる)を詳細に調べて、雌雄によってその大きさが異なることや、季節によってその大きさが変化することを明らかにした(図5)。歌の学習と関連した部位のニューロン数は、繁殖期が終わると40%近く減少するが、次の繁殖期の前までにその数は元のレベルに戻る。Nottebohmらは、このような部位では、成体になってもニューロンが新生されていることを証明した。そして、1990年代初めには、ニューロン新生率を1年間毎月調べて、ニューロン新生率が高い時期と、歌を覚える時期が見事に重なることを明らかにしている11)(図6)。
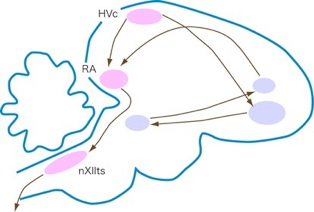
図5鳥の脳の模式図。歌の学習と関連のある高次発生中枢(HVc)、原線条体(RA)ではニューロンが新生している。nXIItsは舌下神経核。
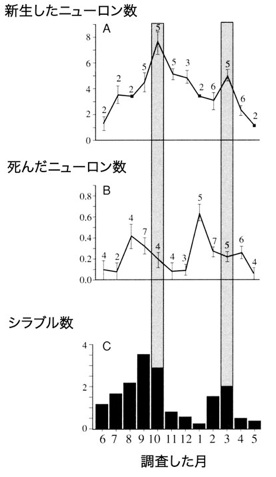
図6高次発生中枢(HVc)のニューロン新生が歌の学習と関連することを示す実験。HVcにおける、新生ニューロン数、死んだニューロン数、鳥の歌のシラブル数の周年変化。ニューロン新生とシラブル数の増減が一致している。それらのピークの少し前に細胞死がたくさん起こる。
サルの悲劇
1980年代には、「成体脳のニューロン新生」に対して、以上のような肯定的な研究がいくつかあったが、一方、神経発生学の大御所Rakicが否定的な論文を著名な科学雑誌Scienceに発表していた12)。彼は成体サルに放射性同位元素のチミジンを注射して、海馬でニューロン新生を調べ、サルでは生後半年以内にニューロンの新生が止まると発表した。彼は結論で、成体の脳でニューロン新生が起こるのはネズミのような下等な哺乳類だけで、サルのような高等なほ乳類では起こらないと述べている。大御所Rakicのこの結果を信じれば、「成体脳のニューロン新生」は、ヒトとは結びつかない、下等哺乳類や鳥類だけの特殊な現象ということになる。これでは、動物学的な問題にはなりえても、ヒトを含めた神経科学全体の問題にはなり得ない。しかし、私には、サルの否定的な結果は不思議とあまり気にならなかった。ネズミと、サルやヒトの海馬の構造がそれほど違わないのに、ニューロン新生についてだけ、そのような差があるとはどうしても思えなかったからだ。
その理由とは?
私が成体脳のニューロン新生の論文を出し始めた1991-1993年3, 7)は、だいたい以上のような状況であった。そして、ほぼ同時期に、ロックフェラー大学のElizabeth Gould13)と岡野ジェームズ洋尚先生14)が、従来のオートラジオグラフィー法を用いて、ニューロン新生の研究を始めていた。結局の所、その当時、ニューロン新生の研究はロックフェラー大学のいくつかの研究室と私の所で細々と生き残っていたのである。なぜ、ニューロン新生の研究が現在のように発展しなかったのか?その原因の一つは、新生ニューロンを検出するために利用されていた、放射性同位元素を用いたオートラジオグラフィー法にあると思う。この方法では、新生ニューロンを検出するまでに数ヶ月待たなければならない。これが最大の原因であろう。現に、私自身も、放射性同位元素を使ったオートラジオグラフィーを使うことには非常な抵抗があった。また、そのような面倒な方法を用いても、結局、細胞の核だけが標識されるだけで、新生ニューロンの全体像を見ることが出来ないことも、研究の発展を妨げていたと思う。しかし、BrdUを使った新生細胞の標識と、PSA抗体を使った免疫組織化学を組み合わせれば、これらの問題は解決する。数日間で、新生ニューロンが検出できるだけでなく、新生ニューロンの樹状突起や軸索を含めた全体像を詳細に観察できる。1993年の時点で、新生ニューロンをこのような方法で見ていたのは、世界の中で私一人だった7)。まるで、暗い森の中を歩いていて、突然、陽の当たる秘密の草地に出たような気分だった。だれも知らないが、明るくてとても気持ちの良い場所である。しかし、このような気分に浸れたのは、1996年までの約3年間だった。1996年に、カリフォルニア大学のFred Gageのグループが、BrdUによる標識とPSA抗体による免疫組織化学という、私の開発した方法を使って、成体海馬のニューロン新生の研究を発表してから、世の中は徐々に騒がしくなってきた15)。 歴史2につづく
参考文献
1) Gross CG (2000) Neurogenesis in the adult brain: death of a dogma. Nat Rev Neurosci 1:67-73.
2) Seki T, Arai Y (1991) Expression of highly polysialylated NCAM in the neocortex and piriform cortex of the developing and the adult rat. Anat Embryol 184:395-401.
3) Seki T, Arai Y (1991) The persistent expression of a highly polysialylated NCAM in the dentate gyrus of the adult rat. Neurosci Res 12:503-513.
4) Altman J, Bayer S (1975) Postnatal development of the hippocampal dentate gyrus under normal and experimental conditions. In: The Hippocampus (Isaacson RL, Pribram KH, eds), pp 95-122. New York: Plenum press.
5) Altman J, Das GD (1965) Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 124:319-335.
6) Nowakowski RS, Lewin SB, Miller MW (1989) Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. J Neurocytol 18:311-318.
7) Seki T, Arai Y (1993) Highly polysialylated neural cell adhesion molecule (NCAM-H) is expressed by newly generated granule cells in the dentate gyrus of the adult rat. J Neurosci 13:2351-2358.
8) Kaplan MS (2001) Environment complexity stimulates visual cortex neurogenesis: death of a dogma and a research career. Trends Neurosci 24:617-620.
9) Kaplan MS, Hinds JW (1977) Neurogenesis in the adult rat: electron microscopic analysis of light radioautographs. Science 197:1092-1094.
10) Nottebohm F (2004) The road we travelled: discovery, choreography, and significance of brain replaceable neurons. Ann N Y Acad Sci 1016:628-658.
11) Kirn J, O'Loughlin B, Kasparian S, Nottebohm F (1994) Cell death and neuronal recruitment in the high vocal center of adult male canaries are temporally related to changes in song. Proc Natl Acad Sci U S A 91:7844-7848.
12) Rakic P (1985) Limits of neurogenesis in primates. Science 227:1054-1056.
13) Gould E, Cameron HA, Daniels DC, Woolley CS, McEwen BS (1992) Adrenal hormones suppress cell division in the adult rat dentate gyrus. J Neurosci 12:3642-3650.
14) Okano HJ, Pfaff DW, Gibbs RB (1993) RB and Cdc2 expression in brain: correlations with 3H-thymidine incorporation and neurogenesis. J Neurosci 13:2930-2938.
15) Kuhn HG, Dickinson-Anson H, Gage FH (1996) Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J Neurosci 16:2027-2033.