成体海馬のニューロン新生:そのルーツを探る
石 龍徳
東京医科大学組織・神経解剖学
東京医科大学雑誌69:433−449(2011)より許可を得て転載
はじめに
従来、「神経細胞は胎児期に生まれ、大人になると新しく生まれることはない。そして、成人の脳では毎日大量のニューロンが死んでいる」との考え方が常識であった。また、神経科学の教科書では、1)脳が損傷を受けた場合、ニューロンが新生して神経組織を再生することはない、2)学習や記憶の成立過程では、ニューロンが新生されることはなく、既存の神経細胞のシナプスに可塑的な変化が生じるという記載が一般的であった。これらは神経科学における一種のドグマであった。
しかし、1990年代後半から新しい技術を用いて、成体の脳でも、海馬(歯状回顆粒細胞層)や側脳室下帯では、ニューロンが新しく生まれていることを示すが証拠が次々と報告された。その結果、100年以上信じられてきた、ニューロン新生に対する否定的なドグマ(Cajalなどの偉大な脳科学者が確立した)は崩れ、パラダイムの大きな転換が起こった 1-3)。現在では、このパラダイムの転換を機に新しい方向の研究がつぎつぎと始まっている。たとえば、1)成体脳でニューロンを新生する神経幹細胞に着目して再生医療を開発する、2)ニューロン新生が生理的(ストレス、運動)な状態により影響を受けることから、ニューロン新生の生理的役割を解明する、3) ニューロン新生がけいれん、虚血、向精神薬の投与により影響を受けることから、これらの病態との関係を解析する、4)ニューロン新生が学習・記憶の成立と密接な関係がある海馬で起こることから、学習・記憶の成立過程での役割を調べるなど多様な研究である。
本総説では、成体海馬におけるニューロン新生過程について解説した後、この様な特殊な部位を形成する過程、すなわち、海馬歯状回顆粒細胞層の形成過程について考察する。
1. 成体脳のニューロン新生の発見
成体脳のニューロン新生が注目を浴びるのは、1990年代後半である。しかし、この現象の最初の発見は、1960年代であり、その発見者は、Joseph Altmanであった。彼はパラダイムの歴史的な転換を起こすような重要な発見をした研究者であるが、研究歴を見ると決して順風満帆な研究者ではなかったことが分かる4)。彼はハンガリーで生まれ、第二次世界大戦前に青春時代を過ごしが、民族的な問題から収容所に入れられてしまう。だが、運良くそこから抜け出し、戦後はドイツ、オーストラリアを経て、1955年にアメリカに渡り研究生活を始めることになる。最初は、コロンビア大学で視覚刺激に反応する部位を、放射線同位元素を使ったオートラジオグラフィーによって調べていた。その後、ニューヨーク大学、マサチューセッツ工科大学と研究の場を変えながら、研究を続けているうちに、成体脳の神経細胞が3H-チミジンを取り込むことを(分裂時に3H-チミジンを取り込んだ細胞が神経細胞になること)、ラットの海馬や嗅球で見つけた(図1, 2)。この結果から、Altmanは、海馬や嗅球では成体になってもニューロンの新生が続いていることを1960年代前半に一連の論文に発表することになる1, 2, 5, 6)。最初は、この説が受け入れられたかに見えたが、やがて否定的な意見に押されるようになる。なぜ、この説が無視されるようになったのかについては、彼のメモワールにその推測が述べられているが4)、正確な事情はナゾである。いずれにしても、つい最近まで、教科書などに「成体脳のニューロン新生」が取り上げられることがなかったことは厳然とした歴史的事実である。
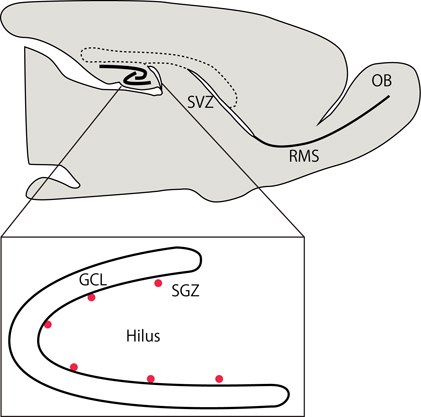
図1 成体脳のニューロン新生部位。枠内は歯状回の拡大図。赤丸は神経幹細胞/神経前駆細胞。GCL, 顆粒細層;Hilus, 歯状回門;OB, 嗅球;RMS, rostral migratory stream;SGZ, 顆粒細胞層下帯、SVZ脳室下帯(Clinical Neuroscience 28: 1344-1347 (2010)より許可を得て転載)
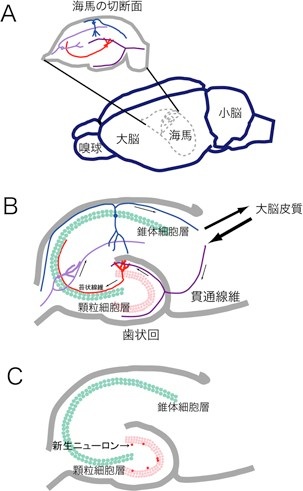
図2 A.ラット脳における海馬の位置。海馬は大脳半球の中に埋もれている。B. 海馬の神経回路。顆粒細胞(赤)は、大脳皮質からの知覚情報を、貫通線維を介して受け取る。その情報は苔状線維によって錐体細胞に伝えられる。錐体細胞の情報は、最終的に大脳新皮質に返されると考えられている。C. 顆粒細胞層の内側では成体になってもニューロンが新生している(赤丸)。( ミクロスコピア 25(2): 19-25 (2008)より許可を得て転載)
2. 成体脳のニューロン新生の“再発見”
この様な状況が打破されるのは、1990年代になってからである。1990年前後では、世界でほんの2-3のグループだけが成体脳のニューロン新生について研究していた 7-9)。その一つは、ロックフェラー大学のBruce S McEwenで、このグループではElizabeth Gouldなどが中心になって、ストレスと成体海馬のニューロン新生について研究していた。もう一つは、鳥類の歌学習と成体脳のニューロン新生の関係を研究していたFernando Nottebohmのグループで、ここでは後に成体ほ乳類のニューロン新生の研究に転じてすばらしい業績を上げるArturo Alvarez-Buyllaなどが研究していた。しかし、いずれにしても、方法としては、Altmanの時代から使われている、3H-チミジンの分裂細胞への取り込みを利用したオートラジオグラフィーを使っており、分裂細胞の検出には、数週間から一ヶ月以上の時間が必要であった。
このような状態であった1990年代前半に、私は、ラット胎仔を抗原として作製した、未熟なニューロンを認識するモノクローナル抗体(抗-PSA-NCAM, ポリシアル化神経細胞接着分子)が、海馬歯状回の顆粒細胞層内側の一部の顆粒細胞だけを染色することを見出した(図3)10-12)。最初は、なぜ一部の顆粒細胞だけが、成体脳の中で未熟な抗原(PSA-NCAM)を発現しているのかが分からなかったが、文献を丹念に調べていった結果、海馬では成体になってもニューロンの新生が続いていることを示すAltmanらの論文を見つけた。そこで、当時、発生学や腫瘍学の研究で使われ始めたチミジンの類似物質BrdU(ブロモデオキシウリジン)をラットに投与して分裂細胞を標識し、未熟ニューロンに特異的に発現するPSA-NCAMとの関係を調べてみた。その結果、分裂して新生したニューロンにPSA-NCAMが発現していることが明らかとなった(図3) 10, 13-15)。これらの実験が、私自身が成体脳のニューロン新生を研究する切っ掛けとなった。最初から、成体脳のニューロン新生を研究しようと思っていたわけでは無かった。というより、当時、成体脳のニューロン新生について知っている研究者はほとんどいなかったので、このような特殊な現象をまったく想像できない時代であった。自ら発見する以外に、研究テーマとして選びようが無かったのである。その後、このBrdUとPSA-NCAMを分子マーカーとした、成体脳のニューロン新生研究法は、他の研究者(現在ではこの分野の大御所であるFred GageやArturo Alvarez-Buyllaなど)にも用いられるようになり16, 17)、やがてはBrdUと様々な分子マーカーの組み合わせで成体脳のニューロン新生を研究することがこの分野の一般的な研究方法となった13, 18)。そのような時期の1998年に、BrdUを投与された患者の死後脳の研究から、ヒトの海馬でもニューロンの新生が起こることが証明された。この頃から、次第に成体脳のニューロン新生に対する興味が高まり、年々この分野の研究者の数が増加していった。現在では、神経発生学、再生医学、神経学、脳外科学、精神医学などの様々な分野で成体脳のニューロン新生に関する論文が毎年多数出版されている。
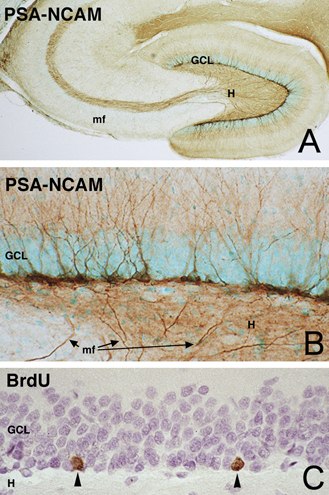
図3 成体ラットの海馬。A, 顆粒細胞層(GCL)の内側にPSA陽性細胞が見られる。顆粒細胞の軸索である苔状線維(mf)にもPSAは発現している。B、顆粒細胞層の拡大図。PSA陽性の未熟ニューロンが、樹状突起を分子層側に、軸索(苔状線維)を歯状回門(H)側に伸ばしている。C. BrdUを投与した時に検出された新生細胞(矢頭)は顆粒細胞層の最内側に位置している。( ミクロスコピア 25(2): 19-25 (2008)より許可を得て転載)
3. 成体脳におけるニューロン新生部位
成体脳の中でニューロンの新生が起こるのは、海馬の顆粒細胞層と側脳室下帯(移動して嗅球のニューロンになる)である(図1)。これ以外の部分では、通常ニューロン新生は起こらないが、神経組織を摘出し、in vitroで培養すると、神経幹細胞様の自己増殖能と多分化能をもつ細胞が取れてくることが報告されている19-21)。また、大脳新皮質でもニューロン新生が起こるとの報告はあるが、これについては反論もあり、まだ結論は出ていない22-26)。
海馬は、記憶や学習の成立と深く関係する部位であると同時に、てんかんや虚血によって傷害を受けやすい部位であり生理的にも病理的にも興味深い部位である。構造的には、大脳新皮質などと比べると単純で、明確な二層の細胞層、錐体細胞層と顆粒細胞層からなる。また、神経回路も比較的単純である。顆粒細胞層の顆粒細胞樹状突起には、大脳新皮質のさまざまな知覚情報が、嗅内皮質を経由して貫通線維となって顆粒細胞の樹状突起に入力される。次に、その情報は、顆粒細胞の軸索である苔状線維によって、錐体細胞に伝えられる。そして錐体細胞層の情報は最終的には再び大脳新皮質に送られる。この海馬の神経回路の中で、ニューロンの新生が起こるのは、顆粒細胞層内側の顆粒細胞下帯(subgranular zone: SGZ)とよばれる部分だけである(図2)。つまり海馬の中で知覚情報を受け取る最初の部分でニューロンの新生が起こる。このことは、海馬のニューロン新生と記憶・学習の関係を考える上で大変興味深い。
側脳室下帯(subventricular zone: SVZ)の場合、側脳室前部の外側(線条体側)でニューロンが新生している。ここで増殖している神経幹細胞が、神経前駆細胞に分化した後、側脳室前端から嗅球に延びるRMS(rostral migratory stream)を通って移動し、嗅球の顆粒細胞や傍糸球細胞になる(図1)。
4. 成体海馬の神経幹細胞の性質
成体の海馬歯状回顆粒細胞層でニューロンの新生が続くということは、顆粒細胞層には成体になっても例外的に神経前駆細胞が存在していることを意味する。この神経前駆細胞(神経幹細胞)の実体については長い間不明であったが、2001年にGFAP(glial fibrillary acidic protein, グリア線維酸性タンパク質)陽性細胞であることが明らかになった27)。GFAP陽性細胞といえば普通アストロサイトを指すが、顆粒細胞層には通常のアストロサイトとは異なるGFAP陽性細胞が存在し、それが顆粒細胞を新生する神経前駆細胞として働いている。GFAP陽性神経前駆細胞の細胞体は、顆粒細胞下帯に位置し、放射状の突起を分子層に伸ばしている。この放射状グリア様細胞は、以前から加齢とともに減少することが知られており28)、ニューロン新生が加齢と共に減少するとの事実と一致する15, 16, 29)。
このGFAP陽性神経前駆細胞がニューロンに分化する過程では、様々な分子が発現することが報告されている。これらの分子は、神経前駆細胞の発達過程を調べるマーカーとして便利である。神経前駆細胞の発達段階を示す用語としては、Kempermann の提唱した分類が広く使われている。我々はこの分類とは異なる考え方を持つが、一般によく使われるのでまずこちらを説明しておく。1型は、GFAP陽性の放射状の突起を持った細胞で、分裂能が低く、神経幹細胞(stem cell)であると考えられている。GFAPの他、放射状グリアのマーカーBLBP、幹細胞マーカーSox2, Pax6なども発現している。神経幹細胞は、自己増殖能と多分化能(ニューロンとグリアに分化する能力)を持つ細胞を示す用語であるが、成体海馬に存在する増殖細胞のニューロスフェアー形成能や多分化能を検討した実験結果から、神経幹細胞が存在することに関しては疑問を持つグループもある30)。このことから一部の研究者は、神経幹細胞との言葉を避け、primary progenitorを用語として用いる。2-3型は、GFAP陰性で、丸型又は水平な短い突起を持った細胞で、分裂能の高い神経前駆細胞と考えられている。2型前期(2a型)には、ニューロン分化に関与するbHLHタンパクのMash1, Tbr2, NeuroDなどが発現している。また、2型後期には未熟なニューロンに発現するDCX、PSA-NCAM、Prox1が発現している。これらは、一般的な幹細胞の定義では、transient amplifying cellと考えられる前駆細胞である。次の3型は、移動するニューロブラストで、この細胞もまだ分裂能を持っている。その後、神経前駆細胞は分裂活性を失った未熟ニューロン(postmitotic neuron)になる1, 31, 32)。
しかし、この分類に当てはまらない事実を我々は発見している。Hu(ニューロンマーカー、RNA結合タンパク)33)とGFAPをマーカーとして神経前駆細胞の性質を調べた結果ところ、GFAP陽性神経前駆細胞の中には、Huを同時に発現するHu/GFAP陽性神経前駆細胞があり、その分裂頻度はそれほど低くないことを見いだした34)。この結果から、GFAP陽性神経前駆細胞は、まずHu/GFAP陽性増殖性神経前駆細胞に分化し、つぎにHu(又はdoublecortin)陽性増殖性神経前駆細胞になり、最終的にニューロンに分化すると考えている(図4)。したがって、GFAP陽性細胞には2種類有り、GFAP+/Hu-とGFAP+/Hu-に分類され、後者はどちらかというとamplifying progenitorに近いと考えている。実際、GFAP-GFPトランスジェニックマウスの生後初期の海馬切片を培養して、in vitroでGFAP+細胞の分裂過程を観察した実験では、ほとんどのGFP陽性細胞は、対称分裂をしてニューロンを産生していた35)。一般的に(例えば大脳新皮質の神経発生では)、幹細胞は非対称分裂してニューロンを産生し、amplifying progenitorは対称分裂してニューロンを産生すると考えられている。このことから、海馬のGFAP陽性神経前駆細胞の一部はamplifying progenitorとしての性質をもつと考えられる。また、BrdUによって神経前駆細胞の発生運命を経時的に調べた実験では、一時的にGFAP陽性神経前駆細胞が増加することが示されている36)。このような一時的な増加は、GFAP陽性神経前駆細胞が対称分裂によってニューロン産生をしていると考えなければ説明がつかない。
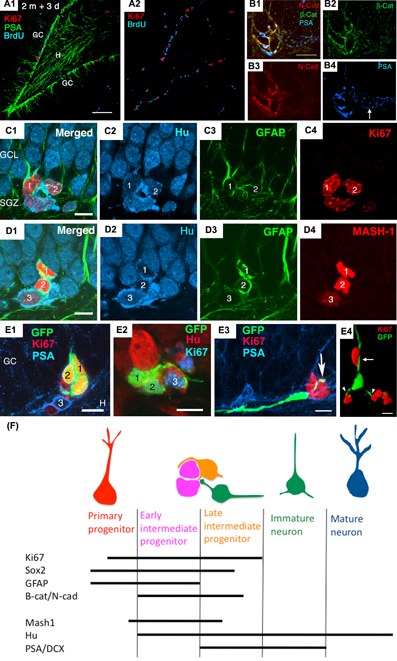
図4 A, 2ヶ月令ラットの歯状回顆粒細胞層。緑はPSA+未熟ニューロン、赤はKi67+増殖ニューロン、青はBrdU投与後3日目のBrdU+ニューロン。こららの陽性細胞は顆粒細胞層の最内側に位置している。B, クラスターを形成している神経前駆細胞には、-catenin 、N-cadherin 、PSAが発現している。C, 顆粒細胞層の最内側で、クラスターを形成している細胞1,2はGFAP, Hu, Ki67 を同時に発現している. D, クラスターを形成している細胞1,2はGFAP, Hu, Mash1を同時に発現している. E, レトロウイルスでGFP標識された増殖細胞。E1-3は標識後3日目、E4は5日目のGFP陽性細胞である。Ki67陽性増殖細胞 1, 2はクラスターを形成している増殖細胞である。クラスターに接するKi67陰性の細胞分裂後の細胞3は、PSAを強く発現する水平な突起をもっている(E1)。 これは水平移動する細胞と思われる。クラスター内の細胞は、時々短い突起で隣接した細胞を囲んでいる(E2)。クラスターから外に水平移動しているように見えるGFP陽性細胞は、Ki67陰性(細胞分裂後の細胞)で長い突起を持つ。このGFP陽性細胞は一方の突起をクラスター内に残しながら移動しているように見える(E3,4)。(Seki et al. 2007を改変。Seki 2011より転載)
5. 神経前駆細胞のクラスター形成
分裂を続けている神経前駆細胞は、PSA-NCAM(or doublecortin)陽性ニューロブラストといっしょになってクラスターを形成している(図4)。興味深いことに、このようなクラスターを形成する細胞には特異的にN-cadherin/β-cateninが強く発現している(図4)。その機能については現在のところ不明だが、発現様式からN-cadherin/β-cateninの接着及び細胞認識機構が、神経前駆細胞の細胞増殖・分化に関わっていることが想像される37, 38)。
神経前駆細胞がニューロンに分化するためには、微小環境が必要であることが、神経幹細胞の移植実験などから指摘されている39)。現在のところ、微小環境としては、GFAP陽性放射状細胞や血管が考えられている40)。増殖性前駆細胞のクラスターは、分裂活性の低いGFAP陽性細胞(神経幹細胞)としばしば接しており、このGFAP陽性細胞が微小環境として働いている可能性が指摘されている41)。つまり、神経幹細胞自体が微小環境を作り出しているという考え方である。また、増殖性神経前駆細胞のクラスターが、顆粒細胞下帯に存在する血管(特に分岐部)付近に高頻度に見いだされることから、血管の細胞が、ニューロン新生に関与するとの考え方もある42, 43)。しかし、増殖性神経前駆細胞の全てがGFAP陽性放射状細胞や血管と接しているわけではない。この点について、我々は、増殖性神経前駆細胞と分裂後のニューロブラストが常に密接な関係を持ち、しかも共にN-cadherin/β-catenin(及びPSA-NCAM)を発現していることから、このような細胞接着因子を介した神経前駆細胞やニューロブラストの細胞相互作用が、微小環境として機能しているのではないかと推測している39, 44)。いずれにしても、増殖性神経前駆細胞とその周囲の細胞要素が一体となって、ニューロン新生に必要な微小環境を作り出していると考えられる。
6. 神経前駆細胞の移動
クラスターを形成している神経前駆細胞が分裂後ニューロブラストになると、PSA-NCAMの発現が増加する。ニューロブラストは水平な突起を伸ばしながら、顆粒細胞下帯を水平方向に移動し、クラスターから抜け出す(図4)。ニューロブラストがクラスターを抜け出すと、β-catenin/N-cadherinの発現が急速に低下する34)。脳内のPSAを酵素(endoN)によって除去すると、未熟ニューロンがクラスターから抜け出す移動が阻害される45)。未熟なニューロンが、水平方向に移動した後、樹状突起を発達させるときには、水平な突起を退縮させながら、垂直な突起を新たに発達させる(図4)。垂直な突起はやがて分子層で分岐し、樹状突起に発達する。しかし、そのような形態になっても、しばらくの間はやや短い水平な突起が残り、基底樹状突起のように見える34)。この基底樹状突起の機能は不明だが、基底樹状突起が存在する部位には、アセチルコリン、セロトニン、GABAなどを含んだ様々な線維終末が密に存在する46, 47)。これらの神経終末が基底樹状突起と関係を持つかどうかは興味深い点である。突起を発達中の新生ニューロンはPSA-NCAMやdoublecortinなどの未熟なニューロンのマーカー分子を発現している。PSA-NCAM陽性未熟ニューロンの一部は軸索をCA3まで伸ばしている28)。最近のRetrovirus-GFPを用いた実験では、新生ニューロンの軸索は、新生後10-11日で、CA3錐体細胞層に達すること明らかにされている48)。
7. シナプス形成
歯状回で新生したニューロンが発達するときにはPSA-NCAMを強く発現している。この発達中の樹状突起を電子顕微鏡で観察してみると、不規則な凹凸の細胞表面が見られ、そこには神経線維終末が接している。ただし、シナプスはあまり見られない28)。このことから、樹状突起が動きながら伸長している時期には、すでにその周囲から神経終末が集まってきていることが推測される。それとは反対に、PSA-NCAMを弱く発現している樹状突起は、スムースな細胞表面をもち、そこにはスパインシナプスが見られる。したがって、樹状突起の形状が安定しつつある時期に、スパインシナプスが形成され始めるのかもしれない。PSA-NCAM発現が新生後3-4週間後に消失することを考えると、その時期までにはシナプス形成がかなり進んでいると考えられる29)。実際、最近のRetrovirus-GFPを用いた実験では、ニューロン新生後15-17日で樹状突起にスパインが形成され始め、スパイン形成のピークは新生後3-4週間後であることが報告されている48)。
PSA-NCAM陽性の新生ニューロンの苔状線維終末には、棒状、扇状など不規則な形状の突起が多数見られる49)。免疫電顕で観察すると、このような構造にはほとんどシナプスが観察されない。しかし、大型で卵形のPSA-NCAM弱陽性苔状線維終末には、小数のシナプスが観察される。このことから、新生ニューロンの苔状線維終末は、不規則な突起を出しながら、シナプス形成の相手を探していることが想像される50)。この様な時期に、苔状線維終末のシナプス形成が、樹状突起に入力される情報によって、どのように影響を受けるのかは興味深い問題である。
8. 胎生期における顆粒細胞層の発生
胎生期には脳のどの部分にも、神経幹細胞は存在する。しかし、生後しばらくするとほとんどの部位では神経幹細胞は消失する。成体期になっても、神経幹細胞が残存する部位は、海馬の顆粒細胞層と前脳側脳室下帯だけである。したがって、これらの部位では他の部分と異なる発生様式があるに違いない。ニューロン新生が成体期まで続くメカニズムを考える上で、これらの部位の発生様式を解明することは非常に重要な課題である。
胎生期の大脳皮質原基(外套)は、ドーム状を呈し、外側、背側、内側に分けられる。この中で、海馬原基は大脳皮質原基の内側から生じる。前後軸も考慮すれば、海馬原基は内尾側方向に位置している。この部分は、cortical hemと呼ばれており、その腹側は脈絡叢に連なっている(図5) 51-54)。外套の外側と背側は大脳新皮質、内側は海馬(原皮質)になる。ドーム状の外套の外側から内側に掛けて、大脳新皮質原基と海馬原基は連続した構造になっている. これらの部分で神経前駆細胞はすべて脳室に面した脳室層(ventricular zone)から発生する。この点では、大脳新皮質と海馬は同じ発生様式を持っているといえる。しかし、海馬でも、歯状回の顆粒細胞層は、その後の発生様式がその他の部位とはかなり異なる。まずは比較のため、一般によく知られている大脳新皮質のニューロン産生様式を考えてみることにする55, 56)。大脳新皮質では、脳室層の神経幹細胞は放射状の細胞で、その突起は、脳室側と軟膜側に接している(図6)。つまり、脳室と軟膜を橋渡しするように突起が伸びている。ここでちょっと、大脳皮質の壁の極性についてちょっと触れておく。発生学的に、大脳皮質の壁は神経管に由来する。神経板は、肥厚した上皮(神経板)が陥入して、その溝(神経溝)の上部が閉じたものである。神経管の前方はさらに膨張し脳胞となり、これが脳の原基である。したがって、上皮細胞の極性を考えると、管腔側(脳室)が上皮の頂上側で、神経管の表面(軟膜側)が結合組織に接する基底側であると考えられる。この極性は、これから述べる新皮質や海馬(錐体細胞層と顆粒細胞層)の発生を考える上で重要である。さて、この放射状細胞は、対称分裂して、自己増殖するか、非対称分裂をして、次の段階の神経前駆細胞と神経幹細胞(自己)を生み出す。非対称分裂をした場合、神経前駆細胞となった娘細胞は、脳室層の上(外側)の脳室下帯subventricular zoneに移動し、中間前駆細胞intermediate progenitor(又はtransient amplifying cell)になる。このintermediate progenitorは、対称分裂して、自己増殖するか、2個の未熟ニューロンを生み出す。新皮質では、神経前駆細胞は基本的に放射状に移動し、新皮質の6層構造を内側から外側に形成していく。
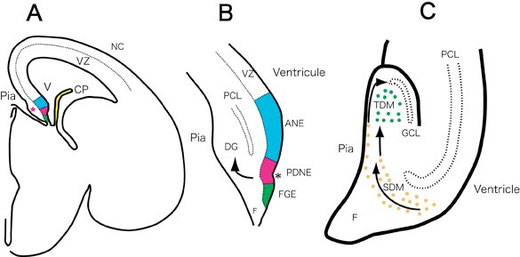
図5 海馬歯状回の顆粒細胞の発生。E16ラット前脳の冠状断面。海馬は、皮質原基の内側(青・赤・緑の部分)から生じる。 赤い星印は将来歯状回原基が形成される部分。B, E16ラット海馬原基の拡大図。脳室層は3つの部分に分けられる:アンモン角神経上皮 Ammonic neuroepithelium (ANE),、1次歯状回神経上皮primary dentate neuroepithelium (PDNE) 、 海馬采グリア上皮fimbrial glioepithelium (FGE)。黒い星印は歯状回切痕dentate notch、矢印は歯状回移動経路dentate migrationを示している。 C, 歯状回顆粒細胞層の形成に係わる2次歯状回マトリックスsecondary dentate matrix (SDM, オレンジ色の丸)と3次歯状回マトリックスtertiary dentate matrix (TDM, 緑の丸)、およびその移動経路。顆粒細胞前駆細胞の移動経路は2つある。一つは、軟膜直下を通るもので、この細胞群は顆粒細胞層(の外郭)を形成する。もう一つは、歯状回門に達するもので、これは3次歯状回マトリックスを形成する。この部分の神経前駆細胞は、顆粒細胞層の内側に顆粒細胞を追加していく(内殻を形成する)。CP, 脈絡叢choroid plexus; DG, 歯状回dentate gyrus; F, 海馬采fimbria; NC, 新皮質neocortex; PCL, 錐体細胞層pyramidal cell layer; V, 脳室ventricle. (Seki 2011より許可を得て転載)
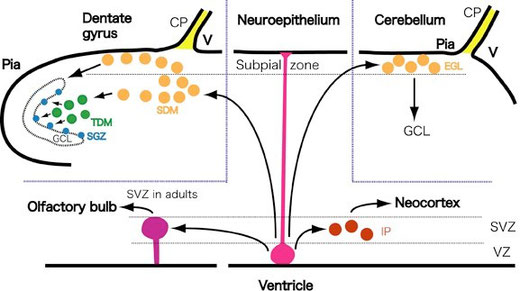
図6 大脳新皮質、側脳室下帯(嗅球のニューロンを新生)、海馬歯状回、小脳のニューロン新生様式の比較。CP, 脈絡叢 choroid plexus; EGL, 外果粒層external granular layer; IP, 中間神経前駆細胞 intermediate progenitors; GCL, 顆粒細胞層 granule cell layer; SDM, 2次歯状回マトリックス secondary dentate matrix; SGZ, 顆粒細胞層下帯 subgranular zone; SVZ, 脳室下帯 subventricular zone; TDM, 3次歯状回マトリックス tertiary dentate matrix; VZ, 脳室層 ventricular zone. (Seki 2011より許可を得て転載)
海馬の場合も、錐体細胞層は、外套の内尾側に位置する脳室層から、基本的に大脳新皮質と同じような様式でニューロンを生み出される。しかし、歯状回の顆粒細胞層は、かなり異なった形式の複雑なニューロン産生様式をとる57-66)。ただし、出発点は、脳室層の神経幹細胞なので、この点は大脳新皮質や海馬の錐体細胞層と同じである。顆粒細胞層の発達期様式については、AltmanとBayerの1990年に発表された論文に詳しいので、この論文を中心に話を進める57, 67, 68)。彼らは、3H-チミジンのオートラジオグラフィーによって、海馬の発生を詳細に調べ、海馬の脳室層の神経発生部位をつぎの3つの部分に分けた。すなわち、アンモン角神経上皮Ammonic neuroepithelium、歯状回神経上皮 primary dentate neuroepithelium、海馬采グリア上皮fimbrial glioepitheliumの3つである。
顆粒細胞の神経幹細胞は、ラットでは胎生16日(E16)ごろ(マウスではE14ごろ)に1次歯状回神経上皮に出現する。この部位は、ちょうど歯状回と海馬采の境界部分で、神経上皮には、切れ込みのようにへこんだ凹部があるので、歯状回切痕dentate notchと呼ばれている(図5A,B)。この部位に出現した神経幹細胞は、大脳新皮質の神経前駆細胞のように単純に放射状に移動して、顆粒細胞層を形成するのではなく、ここからさらに2つの増殖部位を形成していく。dentate notch付近の1次歯状回神経上皮で生まれた神経幹細胞は海馬采上部suprafimbrial regionを通って軟膜側に移動する。この移動をdentate migrationと呼ぶ。この移動経路の神経前駆細胞には活発な増殖能があるので、この部分を2次歯状回マトリックスsecondary dentate matrixと呼ぶ(図5C)。この2次増殖部位から先の移動経路は、2つに分かれる。1つは、軟膜直下subpialを移動する1次歯状回移動経路primary dentate migrationでこれらの細胞は顆粒細胞層を形成していく。この移動細胞は、将来形成される錐体細胞(CA3)の上部suprapyramidalに当たる部分から、U字を描くように顆粒細胞層を形成していき、しだいに錐体細胞層の下部infrapyramidalへ向かうように、細胞層を延ばしていく。この時期に形成されるのは顆粒細胞層の外郭outer shellである。ほぼ完成するのは生後10日目ぐらいである。もう一つの移動経路は、ある程度顆粒細胞層が形成されてから明確になる。これは、歯状回門に相当する部分を顆粒細胞層の内側部に沿って移動する2次歯状回移動経路で、歯状回門に3次歯状回マトリックスを形成する. この増殖部位から生み出されたニューロンは、顆粒細胞層の内側部分に追加され、内殻inner shellを形成していく。最初、3次歯状回マトリックスは、歯状回門全体に広がっていたが、生後はしだいにその増殖部位が顆粒細胞層の内側部に限られてくる69)。生後1ヶ月程すると、その増殖部位は、顆粒細胞層の直下のごく狭い部分に限られ、この増殖帯は、顆粒細胞層下帯subgranular zoneと呼ばれるようになる。このように、顆粒細胞層が内外の2層(外郭、内殻)から形成されることは、キメラ解析によっても証明されている70)。顆粒細胞は、胎生期に全体の15% が形成され、残りの85% は生後に形成される63-65).
9. 胎生期及び生後初期の神経幹細胞の性質
胎生期の神経幹細胞や神経前駆細胞についての性質は、まだよく分かっていないが、我々のGFAP-GFPトランスジェニックマウスを使った予備的な結果では、dentate notch付近で生まれている神経幹細胞/前駆細胞はすでに、GFPを発現しているので、成体の神経幹細胞と同様にアストロサイト様の細胞であると考えられる71)。これらのGFP陽性細胞は、海馬采上部を通って、軟膜側に移動する。2次歯状回マトリックスに存在するGFP陽性細胞の中には、ニューロンマーカーのNeuroDなどを発現する細胞が含まれている。これらの神経前駆細胞によって、歯状回原基では顆粒細胞層が形成されていく。生後初期の海馬歯状回に位置する3次歯状回マトリックスの神経前駆細胞もGFAP、S100β(ラットのみ)、GLAST、nestinなどを発現するアストロサイト様細胞である。BrdUによる追跡実験や海馬切片培養のタイムラプス観察から、このアストロサイト様細胞はニューロンに分化することが示されている35, 69, 72)。
10. 胎生期の顆粒細胞の形成に関与する分子
海馬の形成機構を制御する分子メカニズムについては、ノックアウトマウスを用いた解析から、数々の有用な情報が得られている (表1)。海馬の初期形成は、cortical hemから分泌される分子によって調節を受けている。cortical hemは終脳の形成中心patterning centerの1つであり、海馬形成のオーガナイザーのような働きをしていると考えられている54, 66, 73, 74)。終脳には、2つの形成中心があり、それが大脳皮質の区域化に関与していると考えられている。1つは、前方に位置するanterior neural ridgeで、ここにはfibrobrast growth factors(FGFs)が発現している。これに対し、後方に位置し、海馬形成に関係するcortical hemは、脈絡叢と結合しており、ここには、bone morphogenetic proteins (BMPs) や Wingless/Int proteins (Wnts) 54, 73, 74)が発現している。BMPs を欠損した遺伝子改変マウスでは、脈絡叢が形成されないことが知られている 75)。また、Wnt3Aを欠損したマウスでは、海馬全体が形成されない76, 77)。これに対し、Wnt/β-catenin シグナル経路に関与しているコレセプターのLRP6 78)、細胞質メディエーターのβ-catenin79)、 核メディエーターのLef1 77, 80)を欠損したマウスでは、歯状回が形成されなかったり、顆粒細胞の産生が減少したりする。これらの研究結果は、canonical Wntシグナル系が顆粒細胞の産生に重要であることを示している。BMPやWntは、bHLH転写因子を調節のempty spiracles homoloque 2(Emx2)を制御することが知られているが81, 82)、このEmx2を欠損したマウスでは、顆粒細胞層が形成されない83, 84)。また、lim-homeodomain transcription factorのLhx2はcortical hemに拮抗し、海馬形成を抑制していることがキメラマウスの実験から示されている85)。顆粒細胞層の形成には、Shhも関与していることが報告されている。Shhは、BMP/Wntシグナルと拮抗する分子として知られ、脊髄では背腹軸と細胞の運命の決定に重要な役割を果たしていることがよく知られている。発達中の海馬では、primary cilia に関連したShhシグナルが、神経幹細胞の分化や増殖を制御しているらしい86, 87)。
未熟な顆粒細胞やその神経前駆細胞の移動には、軟膜直下に存在するCajal-Retzius細胞や髄膜などから分泌される分子が重要な働きをすることが報告されている。髄膜が、顆粒細胞層の形成に重要な働きをすることは、Hartmanらによって最初に報告された88)。彼らは、生後直後のラット新生仔の大脳縦裂に6-hydroxydopamineを投与し、髄膜を破壊すると、錐体細胞層下部の顆粒細胞層の形成が阻害されることを示した。錐体細胞層下部の顆粒細胞層は生後に発達することから、この結果は、髄膜が顆粒細胞の産生、顆粒細胞層の形成に重要な役割を果たしていることを示している。髄膜は、歯状回が形成されるときに、海馬溝hippocampal fissureの発達とともにその溝に挟まれる形で入り込むので、完成した海馬-歯状回では海馬溝から海馬采まで存在しており、歯状回の顆粒細胞層の外側全体を覆うことになる。この髄膜には、 stromal-cell-derived factor 1 (SDF-1)/CXCl12が発現しており89)、その受容体のchemokine receptor CXCR4は、2次及び3次歯状回マトリックス(海馬采上部suprafimbrial、 軟膜直下subpial、及び歯状回門 hilar regions)の顆粒細胞前駆細胞に発現している。 CXCR4受容体を欠損したマウスでは、顆粒細胞前駆細胞が顆粒細胞層に到達することが出来ず、歯状回門に残り、顆粒細胞の形成不全が起こる。それゆえ、CXCR4は、顆粒細胞の移動に関与していると考えられている89, 90)。
Cajal-Retzius 細胞は、前脳の軟膜直下の辺縁層marginal zoneに存在する。その役割については、大脳新皮質の発生で詳細に研究されている。大脳新皮質では、Cajal-Retzius細胞 は、細胞外にreelinを分泌して、神経前駆細胞の移動を制御していることが知られている。海馬でも同様に、顆粒細胞の移動に関与していることが報告されている91-93)。reelin は、神経細胞やグリア細胞のvery low-density-lipoprotein (VLDL) 受容体 や apolipoprotein E 受容体 2と結合する分子で、これらの受容体の細胞内ドメインは、 disabled1 (Dab1)というアダプタータンパクと結合する。 また、 β1-class integrinとも結合することが知られている。reelinを欠損した突然変異マウス(reeler)やその関連分子であるDab1を欠損した突然変異マウス(scrambler)では、顆粒細胞の移動に異常が見られる。また、reelin関連分子のβ1-integrinsでも同様の結果が得られている91)。最近の研究では、SDF-1 (CXCl12)/CXCR4シグナル系が軟膜直下の顆粒細胞前駆細胞の増殖部位の形成に関与し、reelinシグナル系が軟膜直下の増殖部位から顆粒細胞下帯への移動に関与していることが報告されている94)。これらの分子は、顆粒細胞前駆細胞が移動するときの足場となる、放射状グリアの形成に影響するのではないかと考えられている。
胎生期の海馬歯状回が形成されるときにはたくさんのGFAP陽性細胞が海馬采上部から歯状回門にかけて観察されている95, 96)。従来、これらの細胞はグリオブラスト(将来グリアになる細胞)や放射状グリア細胞だと考えられてきた。歯状回で放射状グリア細胞が前駆細胞の移動に関与することは完全に証明されている訳ではないが、有力な説の1つである。この説は元々、大脳新皮質で放射状グリア細胞が、神経前駆細胞の移動に関与していることから発想された説である61, 95-99)。放射状グリア細胞の形成に乱れがあるミュータントマウスでは、歯状回の形成に異常が見られることが報告されている。これは、顆粒細胞の前駆細胞の移動に障害があるためと考えられている。前に述べた、SDF-1/CXCR4 94), reelin, Da1, β1-integrins 91) 欠損マウスや、 nuclear factor Ib 98) 欠損マウスの実験から、こららの分子が、放射状グリアの形成と顆粒細胞層の形成にの両方に関与していることが報告されている。しかし、顆粒細胞の前駆細胞が単純に放射状グリアに沿って移動するとは思えない結果もあり、この説は今後もさらに検討される必要があると思われる67)。最近では、顆粒細胞前駆細胞の移動が、精神疾患と関係で注目されているdisrupted-in-schizophrenia1 (DISC1)100)やその関連分子のgirdin 101)によって調節されているとの報告もある。
顆粒細胞の産生は、ニューロンへの運命決定を左右する分子によっても調節を受けている。その様な分子の1つであるNotch1は、顆粒細胞の神経幹細胞/前駆細胞の増殖、細胞周期からの脱却、ニューロン分化などに関わっていることが明らかになっている102)。ニューロン分化に重要な働きをすることが知られているbHLHプロニューラルタンパクのNeurogenin-2 103)やNeuroD104-106)は、顆粒細胞の増殖や分化に必要な因子であることが報告されている。これらのことから、一般的に神経幹細胞の増殖やニューロン分化に重要な働きをする分子が、海馬の顆粒細胞の増殖・分化にも重要な働きをしていることが分かる。
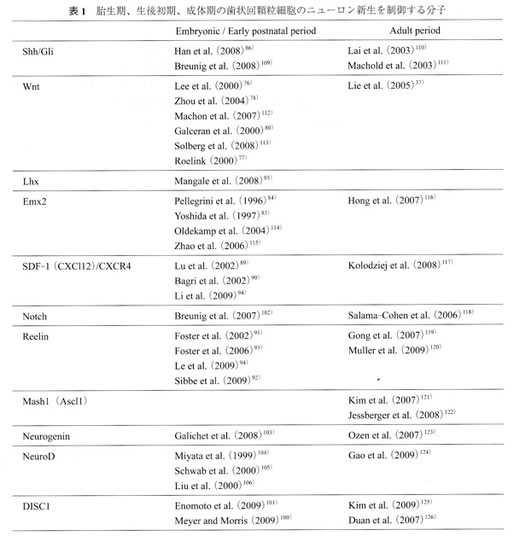
表1 胎生期、生後初期、成体期の歯状回顆粒細胞のニューロン新生を制御する分子
11. 今後の課題と広い視野からの展望
上で述べたように、顆粒細胞の発生に関しては、ノックアウトマウスなどの解析から、様々な分子が関与することが報告されている66)。しかしながら、Altmanらが報告したような、顆粒細胞の神経幹細胞/前駆細胞が形成する増殖部位と、そこからの移動・ニューロン分化にこれらの分子がどのように関わっているのかはまだ明らかではない。たとえば、1次歯状回神経上皮、2次歯状回マトリックス、3次歯状回マトリックスの細胞がどのような分子を発現していて、そのそれぞれがどのような分子の影響を受けて分化し、移動していくのかは、まだ明らかではない。そして、この移動経路の中で、どの細胞が将来成体海馬のニューロン新生を支える神経幹細胞になるのかも分かっていない。
この点について、最近我々は、GFAP-GFPトランスジェニックマウスの解析から、1次歯状回神経上皮、2/3次歯状回マトリックスの細胞は、GFAP(少なくともGFAPmRNA)を発現している細胞であることを明らかにした。また、生後初期の歯状回門に存在する神経前駆細胞はGFAP陽性(ラットでは100β陽性)のアストロサイト様の細胞であり、この細胞から顆粒細胞が産生されることを証明している(Namba et al., 2007; Seki et al., 2009)。このように顆粒細胞がGFAP発現細胞に由来することは、GFAP-Creマウスとリポーターマウスを掛け合わせた実験でも示唆されている107, 108)。
今後は、1)胎生期の海馬原基に出現するGFAP陽性神経幹細胞が、どのようにして次の段階の神経前駆細胞になり、ニューロンに分化していくのか、2)そのうちのどのような細胞が幹細胞としての性質を維持していくのか、3)新皮質から海馬に至る外套の脳室層のうち、海馬の1次歯状回神経上皮だけが、どのようなメカニズムで、顆粒細胞層の形成に関わる神経幹細胞/前駆細胞を産生するのか、4)成体脳でも神経幹細胞の性質を維持する細胞はどこで発生してどのように移動し顆粒細胞層に組み込まれるのか、5)逆に、1次歯状回神経上皮以外の脳室層の神経幹細胞は、いかにして神経幹細胞としての性質が失われるのかなどが重要な課題となるであろう。これらの疑問に答えられないうちは、成体脳のニューロン新生を真に理解することは出来ないであろう。また、このような設問を考えていくと、成体海馬のニューロン新生を解明するには、単に成体でどのようにしてニューロンが新生されているのかを検討するだけでは不十分であることに気がつくであろう。成体脳のニューロン新生の本質を理解するためには、胎生期から成体期までどのようにしてニューロン新生が続くのか、神経幹細胞の性質が維持されるのか、新皮質と歯状回顆粒細胞を形成する神経上皮はどこが違うのかを解明しなければならない。
最後に生後から成体までのニューロン新生を、視野を広げて、大脳新皮質、小脳、海馬歯状回、側脳室下帯で比較してみたい(図6)18)。これらのどの部位でも、最初神経幹細胞は脳室層に存在している。大脳新皮質では、神経幹細胞は放射状の細胞でその突起は、軟膜と脳室層の両方に達している。幹細胞は、分裂するとintermediate progenitorを生み出す。このintermediate progenitorは脳室との接触を失っている。Intermediate progenitorは、何回か対称分裂をして自己増殖をしたり、1対のニューロンを生み出したりする。Intermediate progenitorはその後放射方向に移動しながら、皮質の6層構造を内側から外側に形成していく。発生後期では神経幹細胞はしだいにグリア細胞を産生するようになり、生後しばらくすると消失してしまう。
側脳室下帯では、嗅球の介在細胞の前駆細胞を産生している。この前駆細胞は、rostral migratory streamを通って、嗅球に向かう。側脳室下帯の神経幹細胞は、発生初期には脳室層に存在しているが、その後、上衣層の発達につれて、その部位を脳室下帯に移動させる。しかし、生後の神経幹細胞は脳室側に細い突起を伸ばしており、その突起によって脳室との接触は保たれている。この神経幹細胞は成体でも存続し、ニューロンを産生し続ける。
小脳の顆粒細胞の神経幹細胞は、第4脳室脈絡叢に近い部分(菱脳唇rhombic lip)の脳室層に存在する。そこから軟膜直下に移動し増殖性神経前駆細胞となり、外果粒層external granule cell layerを形成する。この神経前駆細胞は活発に増殖すると共に、一部の神経前駆細胞が、内側に移動しながら軸索である平行線維を伸ばし、小脳の顆粒細胞層を形成していく。このニューロン新生は生後3週目ぐらいまで続けられる。
興味深いことに、歯状回顆粒細胞層のニューロン新生は、他の部位のニューロン新生と共通する要素を持っている。たとえば、歯状回顆粒細胞層も小脳の顆粒細胞層も脳実質の端に当たる脈絡叢近傍(歯状回は側脳室の脈絡叢近傍のcortical hem、小脳は第4脳室の脈絡叢近傍のrhombic lip)の脳室層に由来する。そして、この2つの部位の脳室層から移動した神経前駆細胞は、軟膜の直下で第2の増殖部位を形成する(歯状回では2次歯状回マトリックス、小脳では外果粒層)。そしてこれらの増殖部位から小型の介在ニューロンが産生される。これらの部位のニューロン産生は生後初期の間は続けられるが、その後増殖部位は消失してしまう。ここまでのニューロン新生機構には、歯状回と小脳で共通したメカニズムが存在すると考えられる。しかし、海馬では、2次歯状回マトリックスに加えて、3次歯状回マトリックスが歯状回門に形成され、この増殖部位が、最終的には、顆粒細胞層下帯subgranular zone (SGZ)となって、一生の間、ニューロンの産生を続けることになる。このように、生後すぐニューロン新生を終える大脳新皮質、生後しばらくはニューロン新生を続けるが、成体ではニューロン新生を行わない小脳、そして、一生ニューロン新生を続ける海馬歯状回と側脳室下帯など、様々なニューロン新生部位を比較検討することによって、成体海馬のニューロン新生機構を明確に捕らえることが可能である。今後は、成体脳のニューロン新生を理解する上で、この様な視点も必要であろう。
References
1) Kempermann G: Adult neurogenesis. Oxford University Press, New York, 2006
2) Gross CG: Neurogenesis in the adult brain: death of a dogma. Nat Rev Neurosci 1: 67-73, 2000
3) Jacobson M: Developmental neurobiology. Plenum Press, New York, 1991
4) Altman J: The Discovery of Adult Mammalian Neurogenesis. (Eds) Seki T, Sawamoto K, Parent JM, Alvarez-Buylla A, Springer, Tokyo, 3-46, 2011
5) Altman J: Autoradiographic investigation of cell proliferation in the brains of rats and cats. Anat Rec 145: 573-591, 1963
6) Altman J, Das GD: Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 124: 319-335., 1965
7) Gould E, Cameron HA, Daniels DC, Woolley CS, McEwen BS: Adrenal hormones suppress cell division in the adult rat dentate gyrus. J Neurosci 12: 3642-3650., 1992
8) Gould E, Gross CG: Neurogenesis in adult mammals: some progress and problems. J Neurosci 22: 619-623., 2002
9) Alvarez-Buylla A, Nottebohm F: Migration of young neurons in adult avian brain. Nature 335: 353-354, 1988
10) Seki T, Arai Y: Distribution and possible roles of the highly polysialylated neural cell adhesion molecule (NCAM-H) in the developing and adult central nervous system. Neurosci Res 17: 265-290, 1993
11) Seki T, Arai Y: Expression of highly polysialylated NCAM in the neocortex and piriform cortex of the developing and the adult rat. Anat Embryol 184: 395-401, 1991
12) Seki T, Arai Y: The persistent expression of a highly polysialylated NCAM in the dentate gyrus of the adult rat. Neurosci Res 12: 503-513, 1991
13) Seki T: polysialic acid-expressing cells in adult neurogenesis. Trends Glycosci Glycotechnol 16: 319-330, 2004
14) Seki T, Arai Y: Highly polysialylated neural cell adhesion molecule (NCAM-H) is expressed by newly generated granule cells in the dentate gyrus of the adult rat. J Neurosci 13: 2351-2358, 1993
15) Seki T, Arai Y: Age-related production of new granule cells in the adult dentate gyrus. Neuroreport 6: 2479-2482, 1995
16) Kuhn HG, Dickinson-Anson H, Gage FH: Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J Neurosci 16: 2027-2033, 1996
17) Rousselot P, Lois C, Alvarez-Buylla Ad: Embryonic (PSA) N-CAM reveals chains of migrating neuroblasts between the lateral ventricle and the olfactory bulb of adult mice. J Comp Neurol 351: 51-61., 1995
18) Seki T: From embryonic to adult neurogenesis in the dentate gyrus. (Eds) Seki T, Sawamoto K, Parent JM, Alvarez-Buylla A, Springer, Tokyo, 193-216, 2011
19) Kempermann G: Adult neurogenesis2. oxford university press, Oxford, 2011
20) Shihabuddin LS, Horner PJ, Ray J, Gage FH: Adult spinal cord stem cells generate neurons after transplantation in the adult dentate gyrus. J Neurosci 20: 8727-8735., 2000
21) Suhonen JO, Peterson DA, Ray J, Gage FH: Differentiation of adult hippocampus-derived progenitors into olfactory neurons in vivo. Nature 383: 624-627, 1996
22) Gould E, Reeves AJ, Graziano MS, Gross CG: Neurogenesis in the neocortex of adult primates. Science 286: 548-552, 1999
23) Gould E, Vail N, Wagers M, Gross CG: Adult-generated hippocampal and neocortical neurons in macaques have a transient existence. Proc Natl Acad Sci U S A 98: 10910-10917, 2001
24) Koketsu D, Mikami A, Miyamoto Y, Hisatsune T: Nonrenewal of neurons in the cerebral neocortex of adult macaque monkeys. J Neurosci 23: 937-942, 2003
25) Kishi N, Sohur US, Emsley JG, Macklis JD: Adult neurogenesis and neuronal subtype speification in the neocortex. (Eds) Seki T, Sawamoto K, Parent JM, Alvarez-Buylla A, Springer, Tokyo, 173-187, 2011
26) Kornack DR, Rakic P: Cell proliferation without neurogenesis in adult primate neocortex. Science 294: 2127-2130, 2001
27) Seri B, Garcia-Verdugo JM, McEwen BS, Alvarez-Buylla A: Astrocytes give rise to new neurons in the adult mammalian hippocampus. J Neurosci 21: 7153-7160., 2001
28) Seki T, Arai Y: Temporal and spacial relationships between PSA-NCAM-expressing, newly generated granule cells, and radial glia-like cells in the adult dentate gyrus. J Comp Neurol 410: 503-513, 1999
29) Seki T: Expression patterns of immature neuronal markers PSA-NCAM, CRMP-4 and NeuroD in the hippocampus of young adult and aged rodents. J Neurosci Res 70: 327-334, 2002
30) Seaberg RM, van Der Kooy D: Adult rodent neurogenic regions: the ventricular subependyma contains neural stem cells, but the dentate gyrus contains restricted progenitors. J Neurosci 22: 1784-1793., 2002
31) Zhao C, Deng W, Gage FH: Mechanisms and functional implications of adult neurogenesis. Cell 132: 645-660, 2008
32) Duan X, Kang E, Liu CY, Ming GL, Song H: Development of neural stem cell in the adult brain. Curr Opin Neurobiol 18: 108-115, 2008
33) Okano HJ, Darnell RB: A hierarchy of Hu RNA binding proteins in developing and adult neurons. J Neurosci 17: 3024-3037, 1997
34) Seki T, Namba T, Mochizuki H, Onodera M: Clustering, migration and neurite formation of neural precursor cells in the adult rat hippocampus. J Comp Neurol 502: 275-290, 2007
35) Namba T, Mochizuki H, Suzuki R, Onodera M, Yamaguchi M, Namiki H, Shioda S, Seki T: Time-Lapse Imaging Reveals Symmetric Neurogenic Cell Division of GFAP-Expressing Progenitors for Expansion of Postnatal Dentate Granule Neurons. PLoS One 6:e25303, 2011
36) Steiner B, Kronenberg G, Jessberger S, Brandt MD, Reuter K, Kempermann G: Differential regulation of gliogenesis in the context of adult hippocampal neurogenesis in mice. Glia 46: 41-52, 2004
37) Lie DC, Colamarino SA, Song HJ, Desire L, Mira H, Consiglio A, Lein ES, Jessberger S, Lansford H, Dearie AR, Gage FH: Wnt signalling regulates adult hippocampal neurogenesis. Nature 437: 1370-1375, 2005
38) Nelson WJ, Nusse R: Convergence of Wnt, beta-catenin, and cadherin pathways. Science 303: 1483-1487, 2004
39) Seki T: Microenvironmental elements supporting adult hippocampal neurogenesis. Anat Sci Int 78: 69-78, 2003
40) Alvarez-Buylla A, Lim DA: For the long run: maintaining germinal niches in the adult brain. Neuron 41: 683-686, 2004
41) Song H, Stevens CF, Gage FH: Astroglia induce neurogenesis from adult neural stem cells. Nature 417: 39-44., 2002
42) Shen Q, Goderie SK, Jin L, Karanth N, Sun Y, Abramova N, Vincent P, Pumiglia K, Temple S: Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science 304: 1338-1340, 2004
43) Palmer TD, Willhoite AR, Gage FH: Vascular niche for adult hippocampal neurogenesis. J Comp Neurol 425: 479-494, 2000
44) Seki T: Hippocampal adult neurogenesis occurs in a microenvironment provided by PSA-NCAM-expressing immature neurons. J Neurosci Res 69: 772-783., 2002
45) Burgess A, Wainwright SR, Shihabuddin LS, Rutishauser U, Seki T, Aubert I: Polysialic acid regulates the clustering, migration, and neuronal differentiation of progenitor cells in the adult hippocampus. Dev Neurobiol 68: 1580-1590, 2008
46) Tozuka Y, Fukuda S, Namba T, Seki T, Hisatsune T: GABAergic excitation promotes neuronal differentiation in adult hippocampal progenitor cells. Neuron 47: 803-815, 2005
47) Kaneko N, Okano H, Sawamoto K: Role of the cholinergic system in regulating survival of newborn neurons in the adult mouse dentate gyrus and olfactory bulb. Genes Cells 11: 1145-1159, 2006
48) Zhao C, Teng EM, Summers RG, Jr., Ming GL, Gage FH: Distinct morphological stages of dentate granule neuron maturation in the adult mouse hippocampus. J Neurosci 26: 3-11, 2006
49) Seki T, Arai Y: Different polysialic acid-neural cell adhesion molecule expression patterns in distinct types of mossy fiber boutons in the adult hippocampus. J Comp Neurol 410: 115-125, 1999
50) Seki T, Rutishauser U: Removal of polysialic acid-neural cell adhesion molecule induces aberrant mossy fiber innervation and ectopic synaptogenesis in the hippocampus. J Neurosci 18: 3757-3766, 1998
51) Subramanian L, Tole S: Mechanisms underlying the specification, positional regulation, and function of the cortical hem. Cereb Cortex 19 Suppl 1: i90-95, 2009
52) Li G, Pleasure SJ: Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res 163: 143-152, 2007
53) O'Leary DD, Sahara S: Genetic regulation of arealization of the neocortex. Curr Opin Neurobiol 18: 90-100, 2008
54) Hebert JM, Fishell G: The genetics of early telencephalon patterning: some assembly required. Nat Rev Neurosci 2008
55) Kriegstein AR, Noctor SC: Patterns of neuronal migration in the embryonic cortex. Trends Neurosci 27: 392-399, 2004
56) Rakic P: The radial edifice of cortical architecture: from neuronal silhouettes to genetic engineering. Brain Res Rev 55: 204-219, 2007
57) Altman J, Bayer SA: Mosaic organization of the hippocampal neuroepithelium and the multiple germinal sources of dentate granule cells. J Comp Neurol 301: 325-342, 1990
58) Eckenhoff MF, Rakic P: Radial organization of the hippocampal dentate gyrus: a Golgi, ultrastructural, and immunocytochemical analysis in the developing rhesus monkey. J Comp Neurol 223: 1-21, 1984
59) Rickmann M, Amaral DG, Cowan WM: Organization of radial glial cells during the development of the rat dentate gyrus. J Comp Neurol 264: 449-479, 1987
60) Sievers J, Hartmann D, Pehlemann FW, Berry M: Development of astroglial cells in the proliferative matrices, the granule cell layer, and the hippocampal fissure of the hamster dentate gyrus. J Comp Neurol 320: 1-32, 1992
61) Nakahira E, Yuasa S: Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J Comp Neurol 483: 329-340, 2005
62) Stensaas LJ: The development of hippocampal and dorsolateral pallial region of the cerebral hemisphere in fetal rabbits. V. Sixty millimeter stage, glial cell morphology. J Comp Neurol 131: 423-436, 1967
63) Schlessinger AR, Cowan WM, Gottlieb DI: An autoradiographic study of the time of origin and the pattern of granule cell migration in the dentate gyrus of the rat. J Comp Neurol 159: 149-175, 1975
64) Bayer SA: Development of the hippocampal region in the rat. I. Neurogenesis examined with 3H-thymidine autoradiography. J Comp Neurol 190: 87-114, 1980
65) Angevine JB, Jr.: Time of neuron origin in the hippocampal region. An autoradiographic study in the mouse. Exp Neurol Suppl 2:1-70, 1965
66) Li G, Pleasure SJ: Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci 27: 93-99, 2005
67) Altman J, Bayer SA: Migration and distribution of two populations of hippocampal granule cell precursors during the perinatal and postnatal periods. J Comp Neurol 301: 365-381, 1990
68) Altman J, Bayer SA: Prolonged sojourn of developing pyramidal cells in the intermediate zone of the hippocampus and their settling in the stratum pyramidale. J Comp Neurol 301: 343-364, 1990
69) Namba T, Mochizuki H, Onodera M, Mizuno Y, Namiki H, Seki T: The fate of neural progenitor cells expressing astrocytic and radial glial markers in the postnatal rat dentate gyrus. Eur J Neurosci 22: 1928-1941, 2005
70) Martin LA, Tan SS, Goldowitz D: Clonal architecture of the mouse hippocampus. J Neurosci 22: 3520-3530, 2002
71) Seki T, Osumi N, Imura T, Shioda S: Embryonic neural stem cells of the dentate granule cells express GFAP. Neurosci Res 68, Suppl 1 e366, 2010
72) Namba T, Mochizuki H, Onodera M, Namiki H, Seki T: Postnatal neurogenesis in hippocampal slice cultures: early in vitro labeling of neural precursor cells leads to efficient neuronal production. J Neurosci Res 85: 1704-1712, 2007
73) O'Leary DD, Chou SJ, Sahara S: Area patterning of the mammalian cortex. Neuron 56: 252-269, 2007
74) Subramanian L, Remedios R, Shetty A, Tole S: Signals from the edges: the cortical hem and antihem in telencephalic development. Semin Cell Dev Biol 20: 712-718, 2009
75) Hebert JM, Mishina Y, McConnell SK: BMP signaling is required locally to pattern the dorsal telencephalic midline. Neuron 35: 1029-1041, 2002
76) Lee SM, Tole S, Grove E, McMahon AP: A local Wnt-3a signal is required for development of the mammalian hippocampus. Development 127: 457-467, 2000
77) Roelink H: Hippocampus formation: an intriguing collaboration. Curr Biol 10: R279-281, 2000
78) Zhou CJ, Zhao C, Pleasure SJ: Wnt signaling mutants have decreased dentate granule cell production and radial glial scaffolding abnormalities. J Neurosci 24: 121-126, 2004
79) Machon O, van den Bout CJ, Backman M, Kemler R, Krauss S: Role of beta-catenin in the developing cortical and hippocampal neuroepithelium. Neuroscience 122: 129-143, 2003
80) Galceran J, Miyashita-Lin EM, Devaney E, Rubenstein JL, Grosschedl R: Hippocampus development and generation of dentate gyrus granule cells is regulated by LEF1. Development 127: 469-482, 2000
81) Theil T, Aydin S, Koch S, Grotewold L, Ruther U: Wnt and Bmp signalling cooperatively regulate graded Emx2 expression in the dorsal telencephalon. Development 129: 3045-3054, 2002
82) Shinozaki K, Yoshida M, Nakamura M, Aizawa S, Suda Y: Emx1 and Emx2 cooperate in initial phase of archipallium development. Mech Dev 121: 475-489, 2004
83) Yoshida M, Suda Y, Matsuo I, Miyamoto N, Takeda N, Kuratani S, Aizawa S: Emx1 and Emx2 functions in development of dorsal telencephalon. Development 124: 101-111, 1997
84) Pellegrini M, Mansouri A, Simeone A, Boncinelli E, Gruss P: Dentate gyrus formation requires Emx2. Development 122: 3893-3898, 1996
85) Mangale VS, Hirokawa KE, Satyaki PR, Gokulchandran N, Chikbire S, Subramanian L, Shetty AS, Martynoga B, Paul J, Mai MV, Li Y, Flanagan LA, Tole S, Monuki ES: Lhx2 selector activity specifies cortical identity and suppresses hippocampal organizer fate. Science 319: 304-309, 2008
86) Han YG, Spassky N, Romaguera-Ros M, Garcia-Verdugo JM, Aguilar A, Schneider-Maunoury S, Alvarez-Buylla A: Hedgehog signaling and primary cilia are required for the formation of adult neural stem cells. Nat Neurosci 11: 277-284, 2008
87) Davis EE, Brueckner M, Katsanis N: The emerging complexity of the vertebrate cilium: new functional roles for an ancient organelle. Dev Cell 11: 9-19, 2006
88) Hartmann D, Sievers J, Pehlemann FW, Berry M: Destruction of meningeal cells over the medial cerebral hemispher of newborn hamsters prevents the formation of the infrapyramidal blade of the dentate gyrus. J. Comp. Neurol. 320: 33-61, 1992
89) Lu M, Grove EA, Miller RJ: Abnormal development of the hippocampal dentate gyrus in mice lacking the CXCR4 chemokine receptor. Proc Natl Acad Sci U S A 99: 7090-7095, 2002
90) Bagri A, Gurney T, He X, Zou YR, Littman DR, Tessier-Lavigne M, Pleasure SJ: The chemokine SDF1 regulates migration of dentate granule cells. Development 129: 4249-4260, 2002
91) Forster E, Tielsch A, Saum B, Weiss KH, Johanssen C, Graus-Porta D, Muller U, Frotscher M: Reelin, Disabled 1, and beta 1 integrins are required for the formation of the radial glial scaffold in the hippocampus. Proc Natl Acad Sci U S A 99: 13178-13183, 2002
92) Sibbe M, Forster E, Basak O, Taylor V, Frotscher M: Reelin and Notch1 cooperate in the development of the dentate gyrus. J Neurosci 29: 8578-8585, 2009
93) Forster E, Jossin Y, Zhao S, Chai X, Frotscher M, Goffinet AM: Recent progress in understanding the role of Reelin in radial neuronal migration, with specific emphasis on the dentate gyrus. Eur J Neurosci 23: 901-909, 2006
94) Li G, Kataoka H, Coughlin SR, Pleasure SJ: Identification of a transient subpial neurogenic zone in the developing dentate gyrus and its regulation by Cxcl12 and reelin signaling. Development 136: 327-335, 2009
95) Rickmann M, Amaral DG, Cowan WM: Organization of Radial glial cells during the development of the rat dentate gyrus. J. Comp. Neurol. 264: 449-479, 1987
96) Sievers J, Hartmann D, Pehlemann FW, Berry M: Development of astroglial cells in the proliferative matrices, the granule cell layer, and the hippocampal fissure of the hamster dentate gyrus. J. Comp. Neurol. 320: 1-32, 1992
97) Eckenhoff MF, Rakic P: Radial organization of the hippocampal dentate gyrus: A Golgi, ultrastructural, and immunocytochemical analysis in the developing rhesus monkey. J. Comp. Neurol. 223: 1-21, 1984
98) Barry G, Piper M, Lindwall C, Moldrich R, Mason S, Little E, Sarkar A, Tole S, Gronostajski RM, Richards LJ: Specific glial populations regulate hippocampal morphogenesis. J Neurosci 28: 12328-12340, 2008
99) Yuasa S: Development of astrocytes in the mouse hippocampus as tracked by tenascin-C gene expression. Arch Histol Cytol 64: 149-158, 2001
100) Meyer KD, Morris JA: Disc1 regulates granule cell migration in the developing hippocampus. Hum Mol Genet 18: 3286-3297, 2009
101) Enomoto A, Asai N, Namba T, Wang Y, Kato T, Tanaka M, Tatsumi H, Taya S, Tsuboi D, Kuroda K, Kaneko N, Sawamoto K, Miyamoto R, Jijiwa M, Murakumo Y, Sokabe M, Seki T, Kaibuchi K, Takahashi M: Roles of disrupted-in-schizophrenia 1-interacting protein girdin in postnatal development of the dentate gyrus. Neuron 63: 774-787, 2009
102) Breunig JJ, Silbereis J, Vaccarino FM, Sestan N, Rakic P: Notch regulates cell fate and dendrite morphology of newborn neurons in the postnatal dentate gyrus. Proc Natl Acad Sci U S A 104: 20558-20563, 2007
103) Galichet C, Guillemot F, Parras CM: Neurogenin 2 has an essential role in development of the dentate gyrus. Development 135: 2031-2041, 2008
104) Miyata T, Maeda T, Lee JE: NeuroD is required for differentiation of the granule cells in the cerebellum and hippocampus. Genes Dev 13: 1647-1652., 1999
105) Schwab MH, Bartholomae A, Heimrich B, Feldmeyer D, Druffel-Augustin S, Goebbels S, Naya FJ, Zhao S, Frotscher M, Tsai MJ, Nave KA: Neuronal basic helix-loop-helix proteins (NEX and BETA2/Neuro D) regulate terminal granule cell differentiation in the hippocampus. J Neurosci 20: 3714-3724, 2000
106) Liu M, Pleasure SJ, Collins AE, Noebels JL, Naya FJ, Tsai MJ, Lowenstein DH: Loss of BETA2/NeuroD leads to malformation of the dentate gyrus and epilepsy. Proc Natl Acad Sci U S A 97: 865-870, 2000
107) Garcia AD, Doan NB, Imura T, Bush TG, Sofroniew MV: GFAP-expressing progenitors are the principal source of constitutive neurogenesis in adult mouse forebrain. Nat Neurosci 7: 1233-1241, 2004
108) Ganat YM, Silbereis J, Cave C, Ngu H, Anderson GM, Ohkubo Y, Ment LR, Vaccarino FM: Early postnatal astroglial cells produce multilineage precursors and neural stem cells in vivo. J Neurosci 26: 8609-8621, 2006
109) Breunig JJ, Sarkisian MR, Arellano JI, Morozov YM, Ayoub AE, Sojitra S, Wang B, Flavell RA, Rakic P, Town T: Primary cilia regulate hippocampal neurogenesis by mediating sonic hedgehog signaling. Proc Natl Acad Sci U S A 105: 13127-13132, 2008
110) Lai K, Kaspar BK, Gage FH, Schaffer DV: Sonic hedgehog regulates adult neural progenitor proliferation in vitro and in vivo. Nat Neurosci 6: 21-27, 2003
111) Machold R, Hayashi S, Rutlin M, Muzumdar MD, Nery S, Corbin JG, Gritli-Linde A, Dellovade T, Porter JA, Rubin LL, Dudek H, McMahon AP, Fishell G: Sonic hedgehog is required for progenitor cell maintenance in telencephalic stem cell niches. Neuron 39: 937-950, 2003
112) Machon O, Backman M, Machonova O, Kozmik Z, Vacik T, Andersen L, Krauss S: A dynamic gradient of Wnt signaling controls initiation of neurogenesis in the mammalian cortex and cellular specification in the hippocampus. Dev Biol 311: 223-237, 2007
113) Solberg N, Machon O, Krauss S: Effect of canonical Wnt inhibition in the neurogenic cortex, hippocampus, and premigratory dentate gyrus progenitor pool. Dev Dyn 237: 1799-1811, 2008
114) Oldekamp J, Kraemer N, Alvarez-Bolado G, Skutella T: bHLH gene expression in the Emx2-deficient dentate gyrus reveals defective granule cells and absence of migrating precursors. Cereb Cortex 14: 1045-1058, 2004
115) Zhao T, Kraemer N, Oldekamp J, Cankaya M, Szabo N, Conrad S, Skutella T, Alvarez-Bolado G: Emx2 in the developing hippocampal fissure region. Eur J Neurosci 23: 2895-2907, 2006
116) Hong SM, Liu Z, Fan Y, Neumann M, Won SJ, Lac D, Lum X, Weinstein PR, Liu J: Reduced hippocampal neurogenesis and skill reaching performance in adult Emx1 mutant mice. Exp Neurol 206: 24-32, 2007
117) Kolodziej A, Schulz S, Guyon A, Wu DF, Pfeiffer M, Odemis V, Hollt V, Stumm R: Tonic activation of CXC chemokine receptor 4 in immature granule cells supports neurogenesis in the adult dentate gyrus. J Neurosci 28: 4488-4500, 2008
118) Salama-Cohen P, Arevalo MA, Grantyn R, Rodriguez-Tebar A: Notch and NGF/p75NTR control dendrite morphology and the balance of excitatory/inhibitory synaptic input to hippocampal neurones through Neurogenin 3. J Neurochem 97: 1269-1278, 2006
119) Gong C, Wang TW, Huang HS, Parent JM: Reelin regulates neuronal progenitor migration in intact and epileptic hippocampus. J Neurosci 27: 1803-1811, 2007
120) Muller MC, Osswald M, Tinnes S, Haussler U, Jacobi A, Forster E, Frotscher M, Haas CA: Exogenous reelin prevents granule cell dispersion in experimental epilepsy. Exp Neurol 216: 390-397, 2009
121) Kim EJ, Leung CT, Reed RR, Johnson JE: In vivo analysis of Ascl1 defined progenitors reveals distinct developmental dynamics during adult neurogenesis and gliogenesis. J Neurosci 27: 12764-12774, 2007
122) Jessberger S, Toni N, Clemenson GD, Jr., Ray J, Gage FH: Directed differentiation of hippocampal stem/progenitor cells in the adult brain. Nat Neurosci 11: 888-893, 2008
123) Ozen I, Galichet C, Watts C, Parras C, Guillemot F, Raineteau O: Proliferating neuronal progenitors in the postnatal hippocampus transiently express the proneural gene Ngn2. Eur J Neurosci 25: 2591-2603, 2007
124) Gao Z, Ure K, Ables JL, Lagace DC, Nave KA, Goebbels S, Eisch AJ, Hsieh J: Neurod1 is essential for the survival and maturation of adult-born neurons. Nat Neurosci 12: 1090-1092, 2009
125) Kim JY, Duan X, Liu CY, Jang MH, Guo JU, Pow-anpongkul N, Kang E, Song H, Ming GL: DISC1 regulates new neuron development in the adult brain via modulation of AKT-mTOR signaling through KIAA1212. Neuron 63: 761-773, 2009
126) Duan X, Chang JH, Ge S, Faulkner RL, Kim JY, Kitabatake Y, Liu XB, Yang CH, Jordan JD, Ma DK, Liu CY, Ganesan S, Cheng HJ, Ming GL, Lu B, Song H: Disrupted-In-Schizophrenia 1 regulates integration of newly generated neurons in the adult brain. Cell 130: 1146-1158, 2007