神経細胞の新生の現場をおさえる(2)
ネズミからヒトの研究へ
石龍徳
ミクロスコピア 25(3): 20-25 (2008)より許可を得て転載
脳のニューロンは、成体では新しく生まれることはない。ところが、記憶や学習に関係する海馬では、例外的にニューロンの新生が続いている。この現象は、1990年代 初頭、私を含めた ごく少数の研究者によって研究されていた。しかし、その後の10年間で、多くの研究者に知られるようになり、現在では世界中で活発な研究が行なわれている。いったい、この10年間に何が起こったのだろう?
成体の海馬にニューロンが新生
初めに、科学の一般論を二つあげて、私自身の初期の研究を振り返ってみたい。
「科学は、道具の進歩によって進む。」私の場合、1990年に、私独自道具として、新生ニューロンに固有の分子(ポリシアル酸、PSA)を見つけるモノクローナル抗体を作ることが出来た。これは特別上等の道具ではない。問題は、この道具を どう使うかだ。
「研究は、初めの意図とは違う方向に走り始めることがあるが、その意外な方向に宝が隠されている。」私の場合、新しく生まれたニューロンに発現するPSA分子に対する抗体を使って、初めは胎生期の脳の発生を調べていた。その時、この分子が成体脳では発現していないことを示そうとしたら、思いもかけず、成体の海馬で新生するニューロンが見つかってしまった1)。PSA陽性に染まった若いニューロンが、樹状突起を伸ばす姿は実に 美しいが、こうして生まれ育つニューロンが、既存の神経回路に、新しい神経回路を追加していることを想像すると、いっそう、ゾクゾクしてくる(図1)。
前回 述べたように、成体の海馬にニューロンが新生するという神経学の常識を破る所見は、1965年にマサチューセッツ工科大学のアルトマンJoseph Altmanらによって、ラットで報告されたが2)、サルでは1980年代にボストン大学のラキックPasko Rakicによって否定され3)、神経科学の世界では 黙殺されてしまった。したがって、私がまずやるべきことは、PSAを発現しているニューロンを中心に、成体海馬のニューロン新生を もう一度、全面的に見直すことであった。
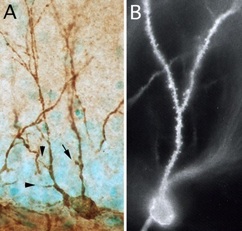
図1 PSAを発現する発達中の顆粒細胞(A)は、何度見ても飽きない。この細胞には、成熟した顆粒細胞(B)の樹状突起で見られるような棘がない。PSAを発現している樹状突起は、成長円錐に似た細長い突起(矢頭)や団扇型の突起(矢印)を伸ばしている。成熟した顆粒細胞は、錐体細胞層に蛍光色素DiIを置いて、逆行性に染色した。
ニューロンの新生はいつまで続く?
第一に、PSAを発現する新生ニューロンが、高齢のラットにも存在することを示さなければならない。新しいことを記憶する海馬にとって、新しいニューロンが追加されることが必要であるのならば、一生のあいだPSA陽性ニューロンが存在するはずである。この問題に答えるために、気長に(1年半!)ラットを飼育して、さまざまな年齢のラットを用意した。そして、新しく分裂した細胞を標識するために、ブロモデオキシウリジン(BrdU、チミジン類似物質でDNA合成時に取り込まれる)を投与した。BrdU抗体とPSA抗体を使って二重免疫染色をした後、縦軸に新生ニューロン数、横軸に年齢をとって グラフを描くと、新生ニューロン数は、反比例のグラフのように、きれいなカーブを描きながら減少していた(図2)。しかし、生後18ヶ月の、巨大な老齢ラットでも、樹状突起と軸索を伸ばしている新生ニューロンが、海馬の一隅にぽつんと見つかった4)。
つまり、高齢になってもニューロン新生が続くのだ。後の話になるが、2002年には、28ヶ月の超高齢マウスのニューロン新生も調べた。その時には、3匹の脳の98切片を丹念に調べて、わずかに12個のPSA陽性細胞、2個のPSA/BrdU二重陽性細胞が検出できた。ここまで調べれば、ニューロンの新生が一生のあいだ続くと言い切っていいだろう5)。
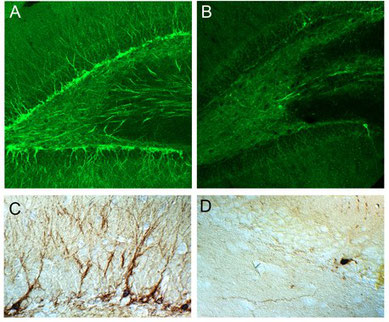
図2 加齢と共にPSA陽性新生ニューロンの数は減少する。2ヶ月令(A,C)と15ヶ月令(B,D)のラット海馬。A, Bは蛍光顕微鏡写真。C、Dはジアミノベンチジン(茶色)とアルカリ性フォスファターゼ(濃青色)を使った二重染色の顕微鏡写真。
新生ニューロンは新しい回路を作るか?
次に大切な課題は、新しく生まれたューロンが 成体の海馬の中で、新しい神経回路を作っていることを示すことである。この目的のために、私は二つの方法を用いた。まず、新生ニューロンの軸索終末が、その標的の錐体細胞の樹状突起まで達することを確認するため、固定した海馬の切片の錐体細胞層に蛍光色素DiIを置いた。この標本を37℃に一週間ほど置いておくと、蛍光色素DiIは軸索をさかのぼり細胞体を赤い蛍光色素で光らせる。この切片を、PSA抗体を用いて免疫染色し、観察してみると、蛍光色素DiIによって赤く標識され細胞の中に、緑色のPSA陽性細胞が見られた(図3, 6)。この結果は、新生ニューロンが軸索をたしかに標的まで伸ばしていることを示している。
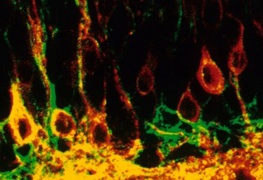
図3 古い共焦点レーザー顕微鏡Zeiss LSM10(観察しているとみるみる蛍光が退色する厄介者)で撮った画像。赤い細胞は、錐体細胞層に置いた蛍光色素DiIによって、逆行性に標識された顆粒細胞。緑の細胞は、PSAを発現している新生ニューロン。黄色い細胞は、新生ニューロンが錐体細胞層まで軸索を伸ばしていることを示している。新しい顕微鏡と比べると画質は悪いが、私にとっては思い出深い画像である。
つぎに、PSA陽性の新生ニューロンの軸索を電子顕微鏡で観察して、シナプス形成の状況を調べてみた。シナプスは、情報を出力するニューロンの軸索突起と、情報を入力する樹状突起との結合部である。今までの研究から、果粒細胞の軸索終末と錐体細胞の樹状突起の間で、シナプスが形成されるときには、次のようなことが起こることが知られていた。まず、軸索終末が樹状突起に接着すると、樹状突起側から小さな突起が軸索終末側に飛び出してくる。つぎに、その突起が成長しながら、シナプスを形成するのである。
そこで電子顕微鏡で成体マウスの海馬をのぞいてみる。PSAの発現部位が黒く見えるようにして、観察すると、PSA陽性の軸索終末が樹状突起に接着しているところが見つかった。よく見てみると、樹状突起の接着面から小さな突起が軸索終末側に侵入していた(図4)。これは まさに、シナプスが形成される現場である。この観察から、PSA陽性の新生ニューロンは、シナプス形成の初期段階にあることが分かった。ところで、このPSAという物質は、ただ標識として研究に役立つだけのものではない。正常なシナプスが作られるさいに必要な分子である。このことは、1995-1997年のアメリカ留学時代に明らかにした6)。
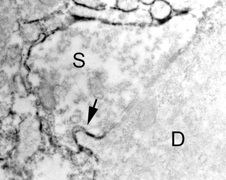
図4 PSAを発現している未熟シナプスボタン(S)で見られるシナプス形成。樹状突起(D)からは、棘(矢印)が伸び出してきて、未熟シナプスボタンに侵入しようとしている。PSA抗体は、分子量の大きなIgM抗体で、組織に浸透しにくかった。前処理を工夫して撮った免疫電顕写真。
大人のサルやヒトでもニューロン新生が起こるのか
ネズミのデータが集まると、いよいよ問題の焦点は、大人のサルやヒトの海馬でもニューロンの新生が起こるか、である。かつてサルのニューロン新生はラキックによって否定されたが、新しい方法を使えば、検出できるかも知れない。これを調べるためには、まず サルを どこかで手に入れなければならない。困ったことに、あまり つてはなかったが、どうにか2匹のニホンザルの海馬を手に入れた。1匹は3歳、もう1匹は5歳以上としか年齢が分からなかった。ラットよりも大分大きいサルの海馬を免疫染色し、どきどきしながら顕微鏡をのぞいてみると、ラットと同じように、果粒細胞層の内側にPSA陽性細胞が見られた(図5)。本当は、もう少し高齢のサルで、PSAの発現もBrdUの取り込みも調べたかったが、そのようなサルを手に入れることは出来なかった。(本当はもっと探すべきだったのだ!)中途半端な実験だったが、私たちの所見は、ラキックらの実験結果をくつがえし、かなり成熟したサルでもニューロンの新生が起こっていることを示していた。
それでは、ヒトでは どうだろう? この点に関するデータは、思わぬところから飛び込んできた。1991年に論文を出版してから、一番初めに関心を示してくれたのは、カリフォルニア大学ロサンゼルス校のバブTL. BabbとマサーンGW. Mathernだった。彼らは、てんかん患者の海馬を調べたいから、PSA抗体を送って欲しいと手紙を送ってきた。彼らの実験結果を記した論文原稿は、私がサルの実験をしている間に送られてきた。見ると、5.5ヶ月から8歳のヒトでPSA陽性細胞が検出されるという、興奮すべきデータだった7)。本当は、成人でもニューロンが新生しているデータが欲しいところだが、とにかく ヒトでも、生後の ある期間、ニューロン新生が起こる可能性は示している。このほか、カリフォルニア州ラホヤのソーク研究所のフレッド・ゲイジFred H. Gageなど海外の研究者からPSA抗体の請求が来て、自分の研究を見ている人が 世界に何人かは いるのだと気づいた。
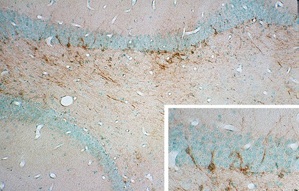
図5 3歳のサルの海馬に見られるPSA発現細胞。右下の写真は一部の拡大。
論文投稿の壁
この様な海外の反応に少し勇気づけられながら、ネズミで得られた上記の結果をまとめ、Scienceに論文を投稿した。論文の議論では、成体海馬のニューロン新生が重要であることを次のように説明した。1)PSA陽性の新生ニューロンは、多数の樹状突起と軸索突起を新しく伸ばすので、成体海馬の神経回路に大きな構造の変化を与える、2)果粒細胞は知覚情報を受け取るので、新生ニューロンのシナプス形成は、知覚情報の影響を受ける可能性がある、3)今回の実験結果は、このような構造的変化が、若い動物ほど大きく起こることを示している、4)学習・記憶の能力は年齢と共に低下することが知られている。これらのことから、成体海馬における起こるニューロン新生は、学習・記憶の成立に重要である可能性があろうと結論した。また、私自身のサルの未発表データとカリフォルニア大学のヒトの てんかん患者の論文を引用して、サルやヒトでも、成体海馬のニューロン新生が、生涯にわたる記憶・学習に重要な役割を果たしていることを強く示唆した。
以上の論文を投稿した結果、レフリーの1人は、非常に高い評価だったが、もう一人は、1993年に私が出版した論文を詳細に知っており、今度の論文は新しくない、と言ってきた。エディターは反論するチャンスをくれたが、結局は論文掲載を拒否されてしまった。その後、米国科学アカデミー紀要に投稿したが、こちらも掲載を拒否された。
そのようなやりとりで、1年半以上の月日が経ってしまったので、データをネズミにおける加齢とニューロン新生の関係に限定して、速報誌(Neuroreport)に投稿した。(エディターの批判を受けて削除せざるを得なかった、シナプス形成の所見は、アメリカ留学後の1999年に2編の論文として出版された6))。しかし、私にとって格別の思い入れのある、新生ニューロンの機能に関する考察と、サルとヒトでもニューロンが新生する知見については、残すことにした。結局こららを記述した論文は、1995年の暮れになって、やっと出版することが出来た4)。
成体脳のニューロン新生:フィーバー始まる
論文が出版されて、ほっとしたのもつかの間、次の年(1996年)の春に、いままで脳移植の研究をしていたゲイジGageのラボから、同じような内容(題名まで似ている!)の論文が突然 出版された。筆頭著者はジョージ・クーンH. Goerge Kuhnで、彼らは、生後6ヶ月と21ヶ月のラットの海馬で、BrdUによる増殖細胞の標識と、PSA抗体(フランスのルーゴンG. Rougonという人からの提供だという)によって新生ニューロンの検出を行ない、老齢ラットではBrdU陽性細胞数もPSA陽性細胞数も低下していることを報告した8)。
その後、このGageのラボからは続々と興味深い論文が現れる。1997年には、ケンパーマンGerd Kempermannらが、乳離れしたばかりのマウスを、通常の飼育箱と、豊かな環境の飼育箱(回し車、トンネルなどの遊び道具がたくさんある)で飼育し、豊かな環境で飼育したネズミは、退屈な環境で飼育したネズミよりも、海馬で新生されるニューロン数が多いことを報告する9)。
そして、1998年には、ついに、ヒトの海馬でニューロンが新生していることを示す、画期的な論文が現れた9)。著者は、Gageのもとに留学したのち、スウェーデンに帰国したエリクソンPeter S. Erikssonらである。彼は、スウェーデンの病院で、舌癌や喉頭癌の患者の腫瘍細胞の増殖率を調べるために、BrdUを投与された患者がいることを知る。彼は、それらの患者の同意を得て、死後脳(57-72歳)を調べさせてもらった。すると、ネズミの結果と同じように、海馬の果粒細胞層の内側にBrdU陽性ニューロンが見つかったのだ。
1999年には、ロックフェラー大学からプリンストン大学へ移ったグールドElizabeth Gouldらが、成人のサルの海馬でもニューロン新生が起こることを証明した6)。また、驚いたことに、1980年代に成体サルのニューロン新生を否定して、アルトマンの大発見の発展を妨げたラキックRakicが、大人のサルでニューロン新生が起こることを、発表している6)。
この時点で、成体の海馬に新しいニューロンが生まれるという知見は、神経科学の世界で市民権を得たと言って良い。成体脳のニューロン新生は、ヒトも含めた動物に見られる共通の現象であり、学習・記憶の成立に関連する可能性が学界で声高に論じられるようになった。グールドElizabeth Gouldは、ストレスによって海馬のニューロン新生が低下することをラットやサルで示した。また、学習をさせると、海馬のニューロン新生が増加することも報告している6)。1997年、カリフォルニア大学サンフランシスコ校のペアレントJack M. Parentらは、実験的にラットに てんかんを起こすと、ニューロン新生が著しく増加することを証明した。翌年には、虚血による障害でも、同様にニューロン新生を増加することが明らかにされた。これらの研究は、傷害を受けた神経組織が、ニューロン新生によって、回復する可能性を示唆しており、臨床系の研究者を大いに刺激した6)。
しかし、なんと言ってもゲイジのグループから出された多数の論文や総説が学界に及ぼした影響は大きい。これらの論文が、21世紀を迎える脳研究を「成体脳のニューロン新生」に引きつける原動力となった。それらの論説では いつも、クーンKuhn(1996年)による論文が、成体ラット海馬のニューロン新生をBrdUとPSA抗体で証明した論文が紹介された。そのため、クーンの論文は、研究者に いつも引用される、記念碑的な論文になっていくのである。
たとえば、神経科学者であり科学史の著述もある、プリンストン大学のグロスCharles G. Grossは、著名な神経科学の総説誌Nature Review Neuroscience(2000年)で、成体の齧歯類のニューロン新生の研究において、BrdU標識を用いたのはGageとその同僚が最初であると述べ、クーン(1996年)の論文8)を引用している10)。私の1993年の論文1)が無視されていることに憤りを感じたので、Grossにメールを送り、自分の論文を引用しつつ、グロスの「思い間違い」を指摘した。すると、次の総説の時にはこの点を訂正しよう、との返事が返ってきた。訂正をしたという総説は、2002年の米国の神経科学雑誌に出版された11)。たしかにその「歴史的な研究」の項の中で、私の1993年1)と1995年4)の論文が引用されてはいるのだが、記述が不正確で、私の研究が、米国の研究の中に埋没するように書かれている。このような記述を読むと、科学者には祖国があり、先取権の争いは「戦争」であると感じる。
出会い
1999年、トロント大学のウォチョウィッツMartin Wotjowiczから、成体脳のニューロン新生についてワークショップを開くから、1時間講演してほしいとの招待が舞い込んだ(図6)。日本から呼ばれた研究者は私一人だけだった。ゲージのグループからは、中心メンバーであるクーン、エリクソン、ケンパーマンらが来ていた。ワークショップに参加して驚いたことの一つは、私の論文を参考文献として引用してくれない研究者も、話し合ってみると、かなり詳しく私のデータについて知っていることだった。嬉しいやら、呆れるやら、いろいろな想いが交錯したワークショップであった。講演では、1991-1995年の間に発表した自分の研究を強調した後、それらの結果や考え方は、その後に出版されたゲージのグループの論文によって支持されていると述べたので大分緊張した。
最後に印象的だった出来事を2つ紹介しよう。ワークショップは、ダウンタウンにあるトロント大学から少し離れたスカーボロフ(Scarborough)キャンパスで開催されたが、会議の始まる前日に行ってみると、コテージの受付が ぽつんとあるだけで、食事をする所など、どこにもないのだった。困ったな、と考えていると、もう一人 受付に入ってきた人物がいて、それが、1996年に老齢ラットについての論文を出した、クーンだった。結局、二人で30分ほど、トボトボと殺風景な道路を歩き、やっと簡単な食事のとれるレストランにたどり着いた。そこで、研究内容や研究環境について楽しく話したが、その時、「あなたの仕事は早すぎた」と言われたことが印象に残っている。
もう一つの楽しい思い出は、最後のパーティーで、ヒトのニューロン新生を証明したエリクソンと話している時のことだ。そのころ、日本では成体のニューロン新生が話題になり、なんと文藝春秋(2000年5月号)で、立花 隆とゲージが対談をしていた!その中に、エリクソンの名前も出てくるので、「あなたは、日本の有名一般雑誌にも名前が出ている」と言ったら、ぜひ その雑誌を送って欲しいというので、カタカナの人名の横にアルファベットを添えて、スウェーデンまで文藝春秋を送った。いまでも彼は、あの雑誌を持っているだろうか? 歴史3につづく。

図6 2000年にカナダのトロントで開かれた、成体脳のニューロン新生に関する会議。会議の目的の一つは、野生動物で成体脳のニューロン新生を調べるグループを将来立ち上げることであった。
参考文献
1) Seki T, Arai Y: Highly polysialylated neural cell adhesion molecule (NCAM-H) is expressed by newly generated granule cells in the dentate gyrus of the adult rat. J Neurosci 13:2351-2358 (1993)
2) Altman J, Das GD: Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 124:319-335. (1965)
3) Rakic P: Limits of neurogenesis in primates. Science 227:1054-1056. (1985)
4) Seki T, Arai Y: Age-related production of new granule cells in the adult dentate gyrus. Neuroreport 6:2479-2482 (1995)
5) Seki T: Expression patterns of immature neuronal markers PSA-NCAM, CRMP-4 and NeuroD in the hippocampus of young adult and aged rodents. J Neurosci Res 70:327-334 (2002)
6) 石龍徳: 成体海馬におけるニューロンの新生. 神経研究の進歩 46:221-236 (2002)
7) Mathern GW, Leite PJ, Pretorius JK, Quinn B, Peacock WJ, Babb TL: Children with severe epilepsy: evidence of hippocampal neuron losses and aberrant mossy fiber sprouting during postnatal granule cell migration and differentiation. Dev. Brain Res. 78:70-80 (1994)
8) Kuhn HG, Dickinson-Anson H, Gage FH: Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J Neurosci 16:2027-2033 (1996)
9) ケンペルマン G, ゲージ FH: 大人でも脳細胞は新生する. 日経サイエンス 29: 36-42 (1999)
10) Gross CG: Neurogenesis in the adult brain: death of a dogma. Nat Rev Neurosci 1:67-73. (2000)
11) Gould E, Gross CG: Neurogenesis in adult mammals: some progress and problems. J Neurosci 22:619-623. (2002)